 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приклади розв’язку завдань. А) послідовність розряду (відновлення) катіонів на катоді при наявності йонів
|
|
Приклад 1. Визначте:
а) послідовність розряду (відновлення) катіонів на катоді при наявності йонів
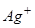
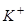
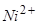
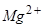
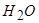
б) послідовність розряду (окиснення) аніонів на аноді:
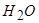
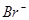
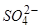
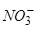
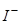
Відповідь: а) Насамперед на катоді будуть розряджатися катіони з найбільш позитивним потенціалом, тобто 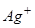 , потенціал якого становить +0,80 В (додаток E); після цього відновлюються йони
, потенціал якого становить +0,80 В (додаток E); після цього відновлюються йони 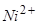 , потенціал відновлення якого
, потенціал відновлення якого
–0,25 В. Потім відновлюються молекули води (–0,41 В). Йони 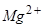 (потенціал –2,36 В) і
(потенціал –2,36 В) і 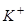 (потенціал –2,92 В) не відновлюються, оскільки знаходяться лівіше від місця розряду молекул води. Тому
(потенціал –2,92 В) не відновлюються, оскільки знаходяться лівіше від місця розряду молекул води. Тому
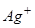 ,
, 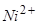 ,
, 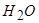 .
.
б) Насамперед розряджаються йони 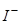 , потенціал окиснення яких становить +0,62 В (додаток Є), потім – Br–, потенціал окиснення яких +1,06 В. Останніми розряджаються молекули води.
, потенціал окиснення яких становить +0,62 В (додаток Є), потім – Br–, потенціал окиснення яких +1,06 В. Останніми розряджаються молекули води.
Аніони оксигеновмісних кислот практично не розряджаються. Тому послідовність розряду аніонів наступна:
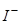 ,
, 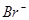 ,
,  .
.
Приклад 2. Поясніть і намалюйте схему електролізу водного розчину калій йодиду з інертним анодом.
Відповідь: стандартний електродний потенціалКалію становить –2,92 В. Тому на катоді розряджаються молекули води і виділяється водень. По мірі розряду йонів водню дисоціюють нові молекули води, внаслідок чого біля катоду утворюється надлишок гідроксильних йонів, а також йони калію, які безперервно переміщуються до катоду, внаслідок чого утворюється КОН. Біля аноду проходить виділення йоду, так як йони йоду розряджаються легше, ніж молекули води. Схема електролізу водного розчину калій йодиду з інертним анодом:
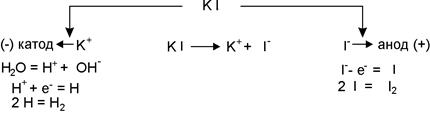
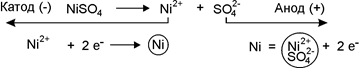
Приклад 3. Поясніть і намалюйте схему електролізу водного розчину NiSO4 з нікелевим анодом.
Відповідь: Розглянемо електроліз водного розчину NiSO4 з нікелевим анодом. Стандартний електродний потенціал
Ni (-0,25 В) трохи більший ніж -0,41 В (потенціал відновлення водню з води), тому під час електролізу нейтрального розчину NiSO4 на катоді відбуваються дві реакції, причому переважатиме процес відновлення нікелю:
Ni+2 + 2 ē → Ni0,
2H2O + 2 ē → H2 + 2OH–.
На аноді окислюється нікель, оскільки потенціал Ni, значно менший за потенціал окиснення води. Отже, електроліз зводиться до розчинення металу аноду і виділення його на катоді:
Дата публикования: 2015-09-18; Прочитано: 494 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
