 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приклади розв’язку завдань. Складіть електронний баланс, доберіть коефіцієнти, вкажіть процеси окиснення та відновлення
|
|
Приклад 1. Для реакції
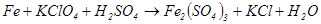
складіть електронний баланс, доберіть коефіцієнти, вкажіть процеси окиснення та відновлення.
Відповідь:
1. Визначаємо ступені окиснення елементів в лівій і правій частинах рівняння:

2. Складаємо схему електронного балансу і визначаємо процеси окиснення та відновлення:
 – процес окиснення;
– процес окиснення;
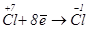 – процес відновлення.
– процес відновлення.
3. Число електронів, відданих відновником, повинно дорівнювати числу електронів, приєднаних окисником. Спільним кратним для 3 і 8 є 24. Визначаємо коефіцієнти для окисника і відновника:


4. Підставляємо одержані коефіцієнти в схему реакції:

5. Урівнюємо інші елементи у ОВР:

6. Перевіряємо правильність написання рівняння реакції за кількістю атомів Оксигену та Гідрогену та інші при необхідності.


Приклад 2. Реакції окисно-відновного сполучення:
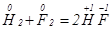




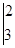
Приклад 3. Реакції окисно-відновного розкладу:
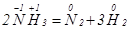


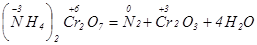
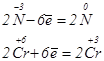

Приклад 4. Реакції окисно-відновного диспропорціо-нування (самоокиснення - самовідновлення):






Приклад 5. Реакції окисно-відновного заміщення:



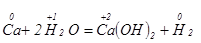
КОНТРОЛЬНІ питання
1. Для реакції:
CrCl3 + Br2 + NaOH → Na2CrO4 + NaCl + NaBr + H2O
а) складіть електронні схеми;
б) вкажіть процеси окиснення та відновлення;
в) підберіть коефіцієнти й складіть повне рівняння реакції.
2. Закінчіть рівняння реакцій:
КMnO4 + FeSO4 + H2SO4 →MnSO4 +...
KMnO4 + Na2S + H2SO4 → S +...
3. Вкажіть, які властивості (відновні, окисні, ті і інші) може виявити підкреслений елемент в реакціях:
S; Fe S; Mn2 O7, Cl2; K Cl O3; S O3, S O2; K Cl O4; H2 S O3.
4. Які з нижчезазначених реакцій відносяться до окисно-відновних. Вкажіть їх тип:
2Pb(NO3)2 = 2PbO + 4NO2 + O2;
2NaNO3 = 2NaNO2 + O2;
NH4NO2 = N2 + 2H2O.
МЕТОДИКА ПРОВЕДЕННЯ ЛАБОРАТОРНОЇ РОБОТИ
Дата публикования: 2015-09-18; Прочитано: 645 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
