 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Класифікація хімічних реакцій
|
|
Всі хімічні реакції можна розділити в загальному підсумку на дві великі групи.
До першої групи належать такі, під час яких ступені окиснення всіх елементів залишаються незмінними. Серед цих реакцій можуть бути обмінні, синтезу, розкладу та комплексоутворення.
Реакції, під час яких змінюється ступінь окиснення хоча би одного елемента, відносять до другої групи, які називаються окисно-відновними. Наприклад:
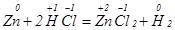 ;
;
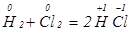 .
.
У першій реакції атоми Цинку передають електрони йонам Гідрогену, а у другій реакції атоми Гідрогену віддають електрони атомам Хлору.
Елемент, який приймає електрони або до якого зсуваються електронні хмари валентних електронів, називають окисником, сам він при цьому відновлюється і його ступінь окиснення зменшується (алгебраїчно).
Елемент, який віддає електрони або від якого відтягується електронна хмара валентних електронів, називають відновником, сам він окиснюється, а ступінь його окиснення зростає.
Зауважимо, що поняття окисник і відновник не абсолютне, а відносне. Залежно від речовини, з якою реагує одна і та ж речовина, вона може бути як відновником, так і окисником, наприклад
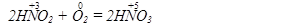
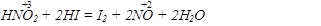
У першій реакції HNO2 - відновник; у другій - окисник.
Необхідно підкреслити, що із збільшенням ступеня окиснення елемента зростають його окисні властивості. Так, в ряду 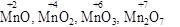 окисні властивості Мангану посилюються.
окисні властивості Мангану посилюються.
Дата публикования: 2015-09-18; Прочитано: 365 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
