 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Складання рівнянь окисно-відновних реакцій
|
|
Підбір коефіцієнтів базується на законі збереження матерії, який стосовно окисно-відновних реакцій означає, що кількість електронів, які віддає відновник, дорівнює кількості електронів, які приймає окисник.
Існує два методи підбору коефіцієнтів окисно-відновних реакцій: метод електронного балансу
- метод йонно-електронного балансу.
Розглянемо метод електронного балансу на прикладі реакції окиснення амоніаку, яке відбувається за такою реакцією:
NH3 + O2 = NO + H2O.
Підбір коефіцієнтів здійснюють у такій послідовності:
1. Визначаємо ступені окиснення всіх елементів – учасників реакції:

2. Визначаємо окисник і відновник:
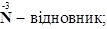
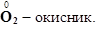
3. Визначаємо, скільки електронів віддає відновник і скільки їх приймає окисник:
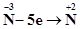

4. Складаємо баланс електронів. Спільним кратним для 5 і 4 є 20. Поділивши 20 на 5, визначаємо коефіцієнт для відновника; а, поділивши 20 на 4, – коефіцієнт для окисника:
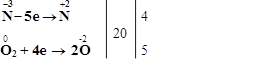
5. Одержані коефіцієнти переносимо у лівий бік рівняння:
4 NH3 + 5 О2 = NO + H2O.
6. Визначаємо всі інші коефіцієнти згідно із законом збереження матерії:
4 NH3 + 5 О2 = 4 NO + 6 H2O.
Метод йонно-електронного балансу застосовують для окисно-відновної реакції в йонному вигляді.
Дата публикования: 2015-09-18; Прочитано: 380 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
