 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приложение. Таблица 1. Предельная электрическая проводимость λ∞ (См см2 /моль) при 25 оС катионов и анионов
|
|
Таблица 1. Предельная электрическая проводимость λ∞ (См см2 /моль) при 25 оС катионов и анионов
| Катион | λ∞,+ | Анион | λ∞,- |
| H3O+ | 349,8 | OH- | 197,6 |
| Li+ | 38,6 | F- | 55,4 |
| Na+ | 50,1 | Cl- | 76,4 |
| K+ | 73,5 | Br- | 78,1 |
| Rb+ | 77,8 | I- | 76,8 |
| Cs+ | 77,2 | NO3- | 71,4 |
| Ag+ | 61,0 | ½ CO32- | 69,3 |
| NH4+ | 73,5 | ½ SO42- | 80,0 |
| ½ Mg2+ | 53,0 | ½ CrO42- | 83,0 |
| ½ Ca2+ | 59,5 | HCO3- | 44,5 |
| ½ Sr2+ | 59,5 | HCOO- | 54,6 |
| ½ Ba2+ | 63,6 | CH3COO- | 40,9 |
| ½ Cu2+ | 56,6 | C2H5COO- | 35,8 |
| ½ Zn2+ | 52,8 | C6H5COO- | 32,3 |
Таблица 2. Удельная электрическая проводимость κ (См/см) водных 0,1 Н
растворов хлорида калия при разных температурах
| Т,оС | |||||||
| κ,См/см | 0,00934 | 0,00979 | 0,01072 | 0,01120 | 0,01167 | 0,01264 | 0,01289 |
Таблица 3. Стандартные электродные потенциалы металлов при 25 оС
| № | Электрод | Электродная реакция | Стандартный потенциал, В |
| Мg2+/Mg | Mg2+ + 2e = Mg | -2,363 | |
| Al3+/Al | Al3+ + 3e = Al | -1,663 | |
| Zn2+/Zn | Zn2+ + 2e = Zn | -0,763 | |
| Fe2+/Fe | Fe2+ + 2e = Fe | -0,440 | |
| Sn2+/Sn | Sn2+ + 2e = Sn | -0,136 | |
| Pb2+/Pb | Pb2+ + 2e = Pb | -0,126 | |
| Cr3+/Cr | Cr3+ + 3e = Cr | -0,91 | |
| 2H+/H2 | 2H+ + 2e = H2 | ||
| Cu2+/Cu | Cu2+ + 2e = Cu | 0,337 | |
| Ag+/Ag | Ag+ + e = Ag | 0,799 |
Литература
1. Болдырев А.И. Физическая и коллоидная химия. - М.: Высш. школа, 1988. С. 408.
2. Гамеева О.С. Сборник задач и упражнений по физической и коллоидной химии. М.: Высшая школа, 1980. С. 191.
3. Дулицкая Р.А., Фельдман Р.И. Практикум по физической и коллоидной химии. М.: Высшая школа, 1978. С. 296.
4. Лабовиц Л., Аренс Дж. Задачи по физической химии с решениями. М.: Мир, 1972. С. 442.
5. Рыбакова Ю.С. Лабораторные работы по физической и коллоидной химии. М.: Высшая школа, 1989. С. 111.
6. Справочник физико – химических величин/Под ред. К.П.Мищенко и А.А.Равделя. Л.: Химия, 1972. С. 200.
7. Фримантл М. Химия в действии. Ч. 2.- М.: Мир, 1991. С 622.
Подписано к печати……………2006 г.
Формат 1/16, объем 2,1 п/л.
Заказ № ………. Тираж 300 экз.
Отпечатано в ЮФ «КАТУ» НАУ
г. Симферополь.
Исполнитель Васецкая М.С.
Контрольные тестовые задания по теме «Электрическая проводимость растворов»
1. Современный взгляд на электролиты предполагает зависимость подвижности ионов от концентрации раствора. Число, показывающее, какую часть максимальной подвижности (при отсутствии межионных сил) составляет подвижность электролита, называется коэффициентом электропроводности,  . Какая физическая величина скрывается под понятием «коэффициент электропроводности»?
. Какая физическая величина скрывается под понятием «коэффициент электропроводности»?
А) Степень диссоциации.
Б) Коэффициент активности.
В) Кажущаяся степень диссоциации сильного электролита.
Г) Изотонический коэффициент.
Д) Осмотический коэффициент.
2. Как изменяется величина удельной электропроводности растворов электролитов с ростом концентрации?
А) Увеличивается.
Б) Уменьшается.
В) Вначале уменьшается, а затем увеличивается.
Г) Вначале увеличивается, а затем уменьшается.
Д) Остается постоянной.
3. В справочнике физико-химических величин указаны численные значения предельной электрической проводимости катионов и анионов при постоянной температуре. Что такое «предельная электрическая проводимость»?
А) Электрическая проводимость насыщенных водных растворов.
Б) Электрическая проводимость очень разбавленных растворов.
В) Электрическая проводимость растворов с концентрацией 1 моль/л.
Г) Электрическая проводимость столбика жидкости, содержащего 1 мл электролита.
Д) Электрическая проводимость при нормальных условиях.
4. Почему значения λ∞ (Н3О+) и λ∞(ОН-) резко отличаются от значений λ∞ других катионов и анионов?
А) Из-за очень малого размера указанных ионов.
Б) Потому что в качестве растворителя выступает вода.
В) Из-за гидратации других ионов в водном растворе.
Г) Благодаря «эстафетной» передаче заряда.
Д) Из-за наличия объемной ионной атмосферы у катионов и анионов.
5. Почему при измерении электрической проводимости растворов используется источник переменного тока?
А) При использовании переменного тока отсутствует электрофоретическое и релаксационное торможение ионов.
Б) Использование источника постоянного тока вызовет электролиз раствора.
В) Для удобства эксплуатации прибора.
Г) При использовании переменного тока ионные атмосферы вокруг ионов не успевают возникнуть.
Д) При использовании источника постоянного тока результаты измерения искажаются из-за электрофоретического и релаксационного торможения.
6. Как найти предельную эквивалентную электрическую проводимость слабого электролита, если отсутствуют справочные данные о его константе диссоциации и λ∞ ионов, слагающих слабый электролит?
А) Экстраполяцией опытных данных, представленных на графике 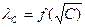 к с → 0.
к с → 0.
Б) По закону Кольрауша.
В) По закону кубического корня.
Г) Комбинацией λ∞ сильных электролитов, содержащих необходимые ионы.
Д) По закону разведения Оствальда.
7. Что подразумевается под выражением «постоянная кондуктометрической ячейки»?
А) Расстояние между электродами ячейки.
Б) Объем электролита, заключенный между плоскими электродами ячейки.
В) Суммарная площадь электродов ячейки.
Г) Объем сосуда, в который помещена кондуктометрическая ячейка.
Д) Отношение расстояния между электродами к к площади электрода.
8. Как известно, метод измерения электрической проводимости нашел применение в объемном анализе под названием «кондуктометрическое титрование».Он широко используется для анализа мутных и окрашенных растворов, которые невозможно титровать с применением обычных индикаторов. Какова физическая сущность метода?
А) Изменение электропроводности раствора в результате протекания реакций ионного обмена или окислительно-восстановительных реакций между анализируемым и титрующим растворами.
Б) Диссоциация веществ на ионы в водном растворе.
В) Замена в растворе более подвижных ионов менее подвижными и наоборот.
Г) Наличие излома на прямой титрования в точке эквивалентности.
Д) Связывание ионов в труднорастворимые или малодиссоциированные соединения.
9. Укажите размерность эквивалентной электрической проводимости в системе СИ.
А) См см2/моль. Б) См/см. В) Ом/м. Г) См м2/моль. Д) Ом м2/моль.
10. Укажите математическое выражение закона разведения Оствальда.
А) λС = λ∞ - А√С Б) КД,с = 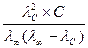 В) αС =
В) αС = 
Г) 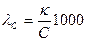 Д) λ∞ = λ∞,+ + λ∞,-
Д) λ∞ = λ∞,+ + λ∞,-
11. Укажите математическое выражение закона независимости движения ионов Кольрауша.
А) λС = λ∞ - А√С Б) КД,с = 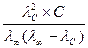 В) αС =
В) αС = 
Г) 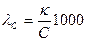 Д) λ∞ = λ∞,+ + λ∞,-
Д) λ∞ = λ∞,+ + λ∞,-
(1.2.1)
Дата публикования: 2015-07-22; Прочитано: 1602 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
