 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кондуктометрическое титрование
|
|
Метод измерения электропроводности нашел применение в объемном анализе под названием «кондуктометрическое титрование». Он широко используется при исследовании мутных и окрашенных растворов, которые невозможно титровать с применением обычных индикаторов. Метод успешно применяется в тех случаях, когда между анализируемым и титрующим растворами протекают реакции ионного обмене или окислительно-восстановительные реакции, в результате которых проводящая способность растворов изменяется. Причиной изменения электропроводности может быть:
*образование малодиссоциированных соединений (реакция нейтрализации);
*выпадение в осадок труднорастворимых соединений (реакции осаждения);
*замена более подвижных ионов менее подвижными и наоборот.
Так как подвижности разных ионов отличаются друг от друга, в точке эквивалентности на прямой титрования (см. график, рис. 1.3.1) наблюдается заметный излом.
Пример 5. Поясните сущность кондуктометрического титрования на примерах реакции нейтрализации едким натром: а) соляной кислоты; б) уксусной кислоты; в) смеси этих кислот.
Решение. а) на рис. 1.2. представлен ход кривых основно-кислотного титрования.
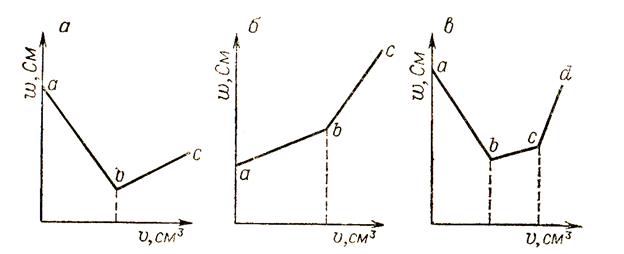
Рис. 1.2. Кривые кондуктометрического титрования кислота + основание.
а) сильная кислота + сильное основание:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O
λ∞(HCl) = 378,3; λ∞(NaCl) = 217,3 См см2/моль.
Электропроводность раствора понижается по мере добавления к титруемому раствору кислоты раствора щелочи за счет связывания катионов водорода и гидроксид - анионов в малодиссоциированное соединение – воду (участок ab). В момент полной нейтрализации в растворе останутся только катионы натрия и хлорид–анионы λ∞(NaCl) = 43,3 + 65,3 = 108,6 См см2/моль – точка b. Дальнейшее прибавление щелочи ведет к повышению электропроводности (участок bc).
б) слабая кислота + сильное основание:
CH3COOH + Na+ + OH- = CH3COO- + Na+ + H2O
На участке ab электропроводность раствора растет вследствие замещения малодиссоциированной кислоты ее солью. После достижения точки эквивалентности (точка b) электропроводность раствора растет еще больше за счет введения избыточных ионов ОН-
в) смесь слабой и сильной кислот + сильное основание:
На графике наблюдается три участка (ab,bc,cd). Первый соответствует титрованию сильной кислоты, второй – слабой, третий – избыточной щелочи.
Пример 6. Рассмотрите ход кривых кондуктометрического титрования на примере реакции осаждения, протекающей между растворами нитрата серебра и хлорида натрия.
Решение. При добавлении к раствору хлорида натрия небольших порций раствора нитрата серебра происходит падение электропроводности за счет связывания катионов серебра и хлорид-анионов в малорастворимую соль. Точка эквивалентности соответствует электропроводности раствора нитрата натрия: λ∞(NaNO3) = 43,5 +61,7 =195,2 См см2/моль.
Ag+ + NO3- + Na+ + Cl- = AgCl↓ + Na+ + NO3-. После прохождения точки эквивалентности электропроводность резко возрастает, так как подвижность ионов серебра превышает подвижность ионов натрия. (Приложение. Табл.1)
При кондуктометрическом титровании нет необходимости в определении константы сосуда и расчете электропроводности. Вместо последней на оси координат можно откладывать величину электрической проводимости L.
L = 1/R (см. раздел 1.2.1).
Пример 7. При кондуктометрическом титровании 25 мл соляной кислоты раствором 5н КОН были получены следующие результаты:
| Объем КОН, мл | 0,32 | 0,60 | 0,92 | 1,56 | 2,00 | 2,35 |
| Удельная электропроводность, См/см | 3,2 | 2,56 | 1,86 | 1,64 | 2,38 | 2,96 |
Определите нормальность кислоты.
Решение. Построим график в координатах κ – V(KOH). Спроектируем точку излома на ось объема и найдем эквивалентный объем щелочи, израсходованной на полную нейтрализацию кислоты, содержащейся в 25 мл исходного раствора. Рассчитаем эквивалентную концентрации соляной кислоты, воспользовавшись формулой: Сэ(НСl)×V(HCl) = Cэ (KOH)×V(KOH)
Ответ: V(KOH)= 1,24 мл; Сэ(НСl) = 0,248 моль/л
Дата публикования: 2015-07-22; Прочитано: 2651 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
