 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Знакомство с устройством и назначением электродов
|
|
По химической природе различают электроды 1 рода – обратимые относительно катиона или аниона и П рода – металлы, покрытые труднорастворимой пленкой соединения этого металла (соль, оксид, гидроксид) в контакте с раствором, содержащим общий анион с труднорастворимым соединением металла. (Для оксида и гидроксида в растворе должен присутствовать анион ОН-).
По назначению различают электроды сравнения с постоянным значением электродного потенциала и индикаторные или детекторные электроды, потенциал которых зависит от концентрации каких – либо катионов или анионов.
Наиболее часто в качестве электродов сравнения используются водородный, каломельный и хлорсеребряный электроды (рис. 2.1).
Водородный электрод – основная эталонная система, применяемая в технике измерений рН и стандартизации буферных растворов. Простейший водородный электрод состоит из колоколообразного стеклянного сосуда, в который вмонтирована стеклянная трубка с платиновой пластинкой или проволокой, адсорбирующей водород. Колокол помещен в открытый сосуд с раствором электролита, содержащим ионы Н+. Уровень исследуемого раствора должен быть на 5 – 10 мм выше отверстий в стенке колокола, а платиновая пластинка погружена в раствор не полностью. Отросток на трубке соединяют через кран с источником водорода, очищенного от примесей кислорода, диоксида углерода, сероводорода и т.п. Верхняя часть платиновой пластинки должна находиться в газовой среде, а нижняя в растворе с ионами Н+. Электрод обратим относительно иона Н+. Схема электрода: aq | H2(г.) (Pt). Равновесный электродный процесс: Н+ +1е- ↔ ½ Н2(г.). При стандартных условиях потенциал водородного электрода равен 0.

Рис. 2.1. Схемы электродов сравнения: а,б – каломельные, в,г – водородные, д – хлор-серебряный.
Хлорсеребряный электрод представляет собой серебряную проволоку, впаянную в стеклянную трубку. Серебро электролитически покрыто слоем хлорида серебра. Трубка заполняется раствором КС1 или НС1. Схема электрода: Ag | AgCl, KCl. Потенциал этого электрода возникает на границе раздела
Ag | Ag+: AgCl + e- ↔ Ag+ + Cl-. В 1Н растворе КС1 при 25оС Е(хс) = 0,2381 В; в 0,1Н растворе Е(хс) = 0,2900 В.
Каломельный электрод проще водородного и используется для калибровки различных электродов. Это вторичный электрод сравнения. Он представляет собой стеклянную трубку, заполненную жидкой ртутью, покрытой пастой из ртути и каломели, находящейся в контакте с раствором хлорида калия, насыщенного каломелью. Схема электрода: Hg2Cl2(тв.),Hg(ж.) | Cl-(насыщ.). На каломельном электроде протекает реакция: Hg2Cl2(тв.) + 2e- ↔ 2Hg(ж.) + 2Cl-(водн.); (Hg2Cl2(тв.) ↔ 2Hg+ + 2 С1). В присутствии КС1 идет высаливание, и концентрация ионов ртути(1) падает. При заданной температуре и концентрации хлорида калия концентрация ионов ртути(1) постоянна и электрод устойчив. В 1Н растворе КС1 при 25оС Е(калом.) = 0,2812 В, в насыщенном растворе КС1 Е(калом.) = 0,2415 В.
В качестве индикаторных электродов используют электроды, потенциал которых зависит от активностей (концентраций) определенных ионов в растворе. Наиболее часто необходимо определять активность ионов Н+ в растворе. Для этих целей используют хингидронный, сурьмяный и стеклянный электроды. На рис. 2.2 приведены схемы стеклянных электродов.

Рис. 2.2. Схемы стеклянных электродов: 1- стеклянный корпус; 2- внутренний раствор; 3- электропроводное стекло.
Стеклянным электродом условно называется система, в состав которой входят: корпус (сосуд с горловиной из изолирующего стекла, на конце которой напаян шарик из специального электропроводного стекла, в котором мигрируют ионы натрия или лития), стандартный внутренний раствор электролита и токовод. Стандартным раствором служит 0,1Н раствор НС1 или буферный раствор с добавками хлоридов или бромидов калия. Тоководом служит серебряный стержень, покрытый хлоридом серебра. В системе возникают две «внутренние» разности электрических потенциалов: одна, характерная для хлорсеребряного электрода, другая – на границе стеклянной мембраны с внутренним раствором. Сумма этих разностей потенциалов в ходе измерения рН остается постоянной, так как состав и концентрация внутреннего раствора постоянны. При помещении стеклянного электрода во внешний раствор с неизвестным рН возникает разность потенциалов на границе стекло – внешний раствор. При этом в поверхностный слой электродного стекла интенсивно проникают ионы Н+. При достижении равновесия ионы Н+ распределяются между стеклом и раствором так, что поверхности фаз приобретают противоположные знаки заряда. Возникает двойной электрический слой и разность потенциалов, зависящая от рН раствора.
Стеклянный электрод универсальный. Он надежен, прост в обращении, имеет высокую точность измерений, устойчив против химических воздействий и радиации. Промышленные электроды маркированы по среде и температуре.
Перед использованием стеклянный электрод вымачивают в течение нескольких суток в растворе НС1 с активностью 0,1 моль/л.
После употребления электрод промывают водой, закрепляют в штатив и хранят в воде или разбавленной НС1.
Обтирать поверхность стеклянного электрода нельзя!
2. 3.2.Применение рН-метрии
Полуреакция, протекающая на водородном электроде, описывается уравнением:
Н+(водн.) + е- ↔ ½ Н2(г.)
Концентрация ионов водорода в водородном полуэлементе может быть связана с электродным потенциалом водородного электрода уравнением Нернста:
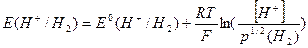 (2.3.1),
(2.3.1),
где  - парциальное давление газообразного водорода. Если предположить, что парциальное давление газообразного водорода равно 1 атм, и учесть, что Е0(Н+/Н2) = 0, то это уравнение существенно упростится:
- парциальное давление газообразного водорода. Если предположить, что парциальное давление газообразного водорода равно 1 атм, и учесть, что Е0(Н+/Н2) = 0, то это уравнение существенно упростится:
 (2.3.2),
(2.3.2),
а поскольку рН = -lg[H+], то
Е(Н+/Н2) = - (0,059) рН (2.3.3)
Таким образом, электродный потенциал водородного электрода прямо пропорционален рН. Электрохимический источник тока, состоящий из электрода, чувствительного к концентрации ионов водорода, и какого-либо электрода сравнения, может служить удобным прибором для определения рН.
На практике вместо водородного электрода для определения рН используется стеклянный электрод, электродный потенциал которого пропорционален концентрации ионов водорода. Стеклянный электрод используется в комбинации с вторичным электродом сравнения – каломельным или хлорсеребряным. ЭДС химического источника тока, состоящего из стеклянного электрода и электрода сравнения, может быть измерена с помощью высокоомного вольтметра, который отградуирован таким образом, что на его шкале указаны непосредственно значения рН. Подобная система называется рН-метром. Предварительно рН-метр калибруется по нескольким буферным смесям с известными значениями рН. На рис 2.3 дана схема устройства рН-метра.
Для электрометрических измерений можно использовать любой потенциометр или рН -метр, со шкалой для непосредственного отсчета рН. (ЛПУ-01, ЛПУ-58, рН -262, рН- 340, ЛПМ-60М).
В этих приборах в качестве эталонного электрода сравнения, как правило, используется каломельный электрод 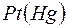 |
| 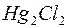 ,
,  , аq, а в качестве индикаторного – стеклянный (стеклянная мембрана с водородной функцией).
, аq, а в качестве индикаторного – стеклянный (стеклянная мембрана с водородной функцией).
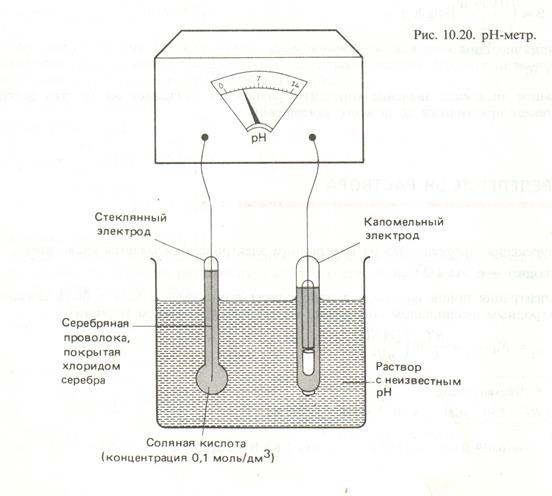
Рис. 2.3. Устройство рН – метра.
Дата публикования: 2015-07-22; Прочитано: 1605 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
