 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Сравнение вычисленных значений с опытными
|
|
Теплоемкостью (C ) называется количество теплоты, необходимое для нагревания тела на один градус. Если нагревается 1 грамм или 1 килограмм вещества, теплоёмкость называют удельной (c), если нагревается 1 моль – молярной (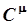 ).
).
Из определения теплоёмкости следует, что
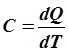 ; ; 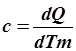 ; ; 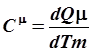 . .
| (6.75) |
В первом случае количество теплоты dQ поделено на число килограммов m, во втором – на число молей n = m/ m.
Величина теплоемкости будет зависеть от условий, при которых проходит нагревание. При постоянном объеме подводимая к газу теплота, затраченная на повышение температуры на один градус, будет меньше, чем если нагревать газ при других условиях: когда газ нагревается при постоянном объеме (плотно закрыт крышкой), подводимая энергия будет затрачивается только на нагревание газа, так как газ не расширяется, сохраняет свой объем постоянным. Такое нагревание газа связано только с увеличением кинетической энергии молекул:
| dQ = dEk. | (6.76) |
Так как средняя кинетическая энергия одной молекулы равна 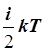 , то кинетическая энергия всех молекул, содержащихся в моле вещества, будет в N 0 раз больше, а в массе газа m – еще в m / m раз больше:
, то кинетическая энергия всех молекул, содержащихся в моле вещества, будет в N 0 раз больше, а в массе газа m – еще в m / m раз больше:
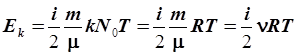 , ,
| (6.77) |
где n – число молей вещества.
Следовательно, при постоянной массе вещества (и неизменном числе степеней свободы!) изменение кинетической энергии может происходить лишь за счет температуры. Поскольку подводимая теплота dQ целиком идет на изменение кинетической энергии движения молекул, то теплоемкость при постоянном объеме может быть найдена так:
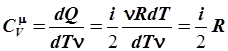 . .
| (6.78) |
Полученный результат свидетельствует, что теплоемкость всех газов с одинаковым числом степеней свободы одинакова.
Если условия нагревания будут иными, например, если газ будет помещен под подвижный поршень, нагревание газа будет сопровождаться его расширением. Расширение будет происходить до тех пор, пока давление внутри сосуда не уравновесится внешним, то есть процесс нагревания будет происходить при постоянном давлении, равном атмосферному. В этом случае подводимая теплота, помимо нагревания, пойдет еще и на совершение работы: dQ = dE k + dA. Работа газа может быть найдена по (6.5): dA = pdV, тогда:
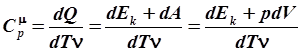
| (6.79) |
Продифференцируем уравнение Менделеева-Клапейрона (6.9) при условии p = const:
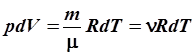 . .
| (6.80) |
Подставив это, а также значение Ek по (6.77) в выражение (6.79), получим:
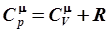 . .
| (6.81) |
Последнее равенство носит название уравнения Р. Майера. Оно свидетельствует, что разница между теплоемкостями 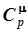 и
и 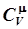 равна работе, которую производит один моль газа при нагревании на один градус. Из (6.81) и (6.78) следует, что теплоемкость при постоянном давлении также не зависит от температуры:
равна работе, которую производит один моль газа при нагревании на один градус. Из (6.81) и (6.78) следует, что теплоемкость при постоянном давлении также не зависит от температуры:
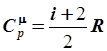 . .
| (6.82) |
Отношение теплоемкостей при постоянном давлении к теплоемкости при постоянном объеме
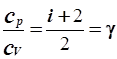
| (6.83) |
зависит только от числа степеней свободы молекул газа и равно показателю адиабаты g (см. уравнение 6.8).
Итак, согласно теории, теплоемкость идеального газа не зависит ни от температуры, ни от индивидуальных особенностей газа. Обе теплоемкости могут быть легко вычислены для газов с различными степенями свободы. Этот расчет открывает возможность для сравнения теоретических значений теплоемкостей с опытными значениями, чтобы тем самым проверить истинность идей, легших в основу уравнений (6.78) и (6.82). Теплоемкость тел, находящихся в любом агрегатном состоянии, можно легко определить опытным путем по различным широко известным и хорошо разработанным методикам.
Ниже приведена табл. 6.1, где сравниваются вычисленные по (6.80) теплоемкости с опытными значениями этой величины, найденными для разных газов при комнатной температуре.
Очень хорошее совпадение с опытом – до третьего знака включительно – наблюдается для одноатомных газов. Расхождение с опытом по мере возрастания числа степеней свободы имеет место сначала в третьем знаке, а затем и во втором знаке – для газов с шестью степенями свободы. Это расхождение может быть устранено учетом колебательных движений (колебательных степеней свободы) более крупных молекул.
Таблица 6.1
| Газ | i | 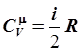 , Дж/(моль×К) , Дж/(моль×К)
| Опытные значения
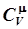 ,
Дж/(моль×К) ,
Дж/(моль×К)
| |
| Гелий Аргон | He Ar | 12,47 | 12,50 12,45 | |
| Кислород Азот | O2 N2 | 20,79 | 20,60 20,70 | |
| Аммиак Водяной пар | NH3 H2O | 24,94 | 20,80 20,83 |
Иначе обстоит дело с явным противоречием теории и эксперимента относительно зависимости теплоемкости от температуры. Равенства (6.78) и (6.82) предсказывают постоянство величин cV и c p, их независимость от температуры. В табл. 6.2 показано изменение теплоемкости водорода с повышением температуры, полученное на опыте. Оно столь значительно, что им нельзя пренебречь. Наблюдаемая зависимость теплоемкостей и других газов от температуры явилась поводом для критического анализа основ классической молекулярно-кинетической теории и переходом к квантовым представлениям.
Таблица 6.2
Дата публикования: 2014-10-19; Прочитано: 557 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
