 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторные методы исследования
|
|
- ОБЩИЙ АНАЛИЗ КРОВИ сдается утром натощак. При воспалительных заболеваниях органов дыхания наблюдается лейкоцитоз, ускорение СОЭ, сдвиг лейкоцитарной формулы влево.
- Исследование МОКРОТЫ.
МОКРОТА –патологическое отделяемое органов дыхания при кашле.
А / ОБЩИЙ АНАЛИЗ мокроты собирают в чистую светлую емкость и направляют в клинико-диагностическую лабораторию (КДЛ). В лаборатории оценивают КОЛИЧЕСТВО, КОНСИСТЕНЦИЮ, ХАРАКТЕР и ЦВЕТ.
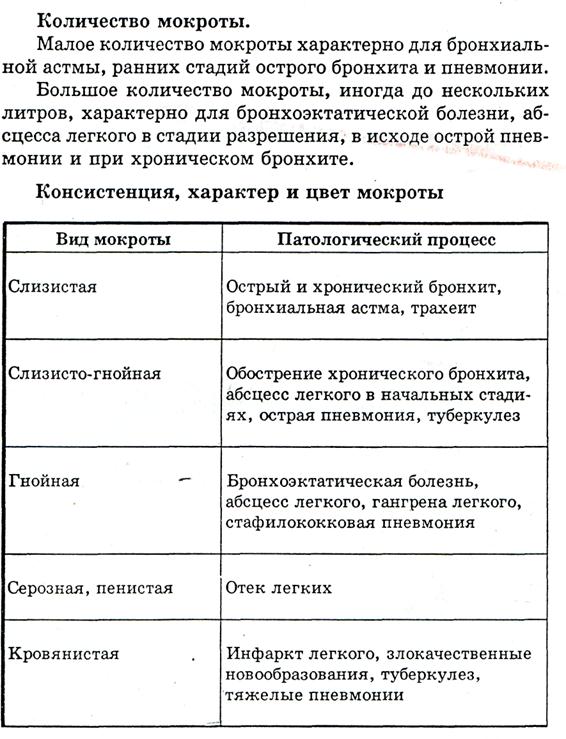
Мокрота трехслойная - обильная гнойная М., разделяющаяся при отстаивании на три слоя: верхний – сероватый пенистый, средний – водянистый прозрачный и нижний – грязного серо-зеленого цвета, содержащий гной и остатки некротизированных тканей; наблюдается при гангрене легких.
Затем на предметное стекло петлей наносится капля мокроты, делается мазок и смотрится под микроскопом. При микроскопии в мокроте определяют клеточные элементы.
КЛЕТОЧНЫЕ ЭЛЕМЕНТЫ МОКРОТЫ
| КЛЕТОЧНЫЕ ЭЛЕМЕНТЫ | ПАТОЛОГИЧЕСКИЙ ПРОЦЕСС |
| Цилиндрический эпителий, лейкоциты в умеренном количестве | Острый бронхит |
| Лейкоциты в большом количестве, эритроциты. макрофаги | Хронический бронхит |
| Лейкоциты в большом количестве, холестерин, пробки Дитриха, различная микрофлора | Бронхоэктатическая болезнь |
| Серозная, пенистая | Отёк лёгких |
| Кровянистая | Инфаркт лёгкого, злокачественные новообразования, туберкулёз, тяжелые пневмонии |
| Цилиндрический эпителий, кристаллы Шарко-Лейдена, спирали Куршмана, эозинофилы | Бронхиальная астма |
| Лейкоциты в большом количестве, эритроциты. Макрофаги, сгустки фибрина | Крупозная пневмония |
| Лейкоциты в большом количестве, Эластические волокна, холестерин, обильная микрофлора | Абсцесс лёгкого |
| Эластические волокна, рисовидные тельца Коха, микобактерии туберкулёза, эритроциты | Туберкулёз |
| Обрывки тканей, эритроциты, атипические клетки | Бронхолёгочный рак |
Б) БАКТЕРИОЛОГИЧЕСКИЙ АНАЛИЗ МОКРОТЫ –определение микрофлоры Собирают в стерильную банку или в чашку Петри.
Направляется в бактериологическую лабораторию в течение часа. В лаборатории делают посев мокроты на питательную среду петлей зигзагами и ставят чашку Петри в термостат Результат читают через 24-48-72 часа.
Затем определяют ЧУВСТВИТЕЛЬНОСТЬ МИКРОБОВ К АНТИБИОТИКАМ. На выросшие колонии прикрепляются диски-маркеры, пропитанные антибиотиками. Чашку оставляют на столе на сутки. Результат читают по наибольшему светлому пятну.
В) АНАЛИЗ МОКРОТЫ НА КУМ(микобактерии туберкулеза).
· Методические рекомендации «Организация выявления больных туберкулезом в амбулаторно-поликлинических и больничных учреждениях». Утверждены заместителем Министра здравоохранения и социального развития Российской Федерации Р.А.ХАЛЬФИНЫМ 20 июля 2007 г. N 5589-РХ
Целью данного этапа является определение наличия/отсутствия кислотоустойчивых микобактерий в мокроте методом прямой микроскопии среди лиц с подозрением на туберкулез по клиническим и/или рентгенологическим симптомам.
К ним относятся:
1. Обратившиеся за медицинской помощью с респираторными жалобами или симптомами интоксикации, характерными для туберкулеза (выявление по обращаемости).
2. Лица с изменениями, выявленными лучевыми методами или входящие в группы риска по заболеванию туберкулезом (активное выявление).
3. Привлеченные к обследованию (активное выявление) по результатам применения клинического метода.
4. Больные, находящиеся под наблюдением врачей узких специальностей по поводу ряда хронических заболеваний (активное выявление)Для того чтобы уменьшить число ежедневных визитов пациента в медицинское учреждение для посещения врача и сдачи 3 утренних проб мокроты, практикуется следующая тактика.
Первую пробу мокроты пациент собирает при первом посещении медицинского учреждения под непосредственным наблюдением медицинского работника. По завершении процедуры сбора мокроты пациент получает стерильный флакон для сбора мокроты на следующий день. Одновременно медицинский работник, ответственный за сбор материала, объясняет пациенту необходимость сбора мокроты и правила ее сбора в домашних условиях.
Вторую пробу пациенту предлагается собирать самостоятельно утром следующего дня и доставить ее в лабораторию.
Третья проба собирается под наблюдением медицинского работника в день второго посещения после сдачи второй пробы материала.
Если же пациент не выделяет мокроту или выделяет ее только эпизодически и в скудном количестве, то накануне вечером и рано утром в день сбора мокроты следует дать ему отхаркивающее средство или применить раздражающие ингаляции.
Сбор мокроты должен производиться в присутствии и при непосредственном участии медицинского персонала.
1. Лицам, ответственным за сбор мокроты, следует объяснить пациенту причины исследования и необходимость откашливать не слюну или носоглоточную слизь, а содержимое глубоких отделов дыхательных путей, что достигается в результате продуктивного кашля, возникающего после нескольких глубоких вдохов.
2. Необходимо предупредить пациента, что он должен предварительно почистить зубы и прополоскать полость рта кипяченой водой, что позволяет механически удалить основную часть вегетирующей в ротовой полости микрофлоры и остатки пищи, загрязняющие мокроту и затрудняющие ее обработку.
3. Участвующий в сборе мокроты медицинский работник в маске, резиновых перчатках и резиновом фартуке должен находиться за спиной пациента, выбирая свое положение таким образом, чтобы направление движения воздуха было от него к пациенту. Медицинский работник должен открыть стерильный флакон для сбора мокроты, снять с него крышку и передать его пациенту.
4. Стоя позади пациента, следует рекомендовать ему держать флакон как можно ближе к губам и сразу же сплевывать в него мокроту по мере ее откашливания. Выделение мокроты усиливается после одного или нескольких глубоких вдохов.
5. По завершении сбора мокроты медицинский работник должен закрыть флакон крышкой, оценить количество и качество собранного материала, занести эти данные в направление. Флакон с собранной порцией мокроты тщательно закрывают завинчивающейся крышкой, маркируют и помещают в специальный бикс или ящик для транспортировки в лабораторию.
Материально-техническое обеспечение.
Материал для исследования на кислотоустойчивые микобактерии собирают в стерильные флаконы с плотно завинчивающимися крышками, емкостью 20 - 50 мл, иметь широкое отверстие (не менее 35 мм в диаметре), чтобы пациент мог легко сплевывать мокроту внутрь флакона. Для возможности оценки количества и качества собранной пробы флаконы должны быть изготовлены из прозрачного материала. При применении герметизированных флаконов предотвращается попадание МБТ во внешнюю среду, предохраняется исследуемый материал от загрязнения широко распространенными в окружающей среде кислотоустойчивыми микобактериями.
Хранение и транспортировка диагностического материала.
Хранение материала. Если в данном медицинском учреждении не проводятся микроскопические исследования на выявление кислотоустойчивых микобактерий, собранный диагностический материал должен как можно быстрее централизованно доставляться в лабораторию. До момента отправки в лабораторию герметично закрытые флаконы с материалом хранятся в холодильнике при температуре от 4 до 8 °С, который по окончании каждого рабочего дня опечатывается и запирается. Срок сохранения материала в холодильнике не должен превышать 48 - 72 часа. При более длительном хранении необходимо применить консервирующие средства.
Транспортировка. Доставка может осуществляться немедленно, 1 - 2 раза в неделю при условии обязательного сохранения материала в промежутках между доставками в холодильнике или с применением консервантов.
Транспортировка санитарным транспортом.
Во время транспортировки материал следует предохранять от воздействия прямых солнечных лучей и тепла.
Для транспортировки материала рекомендуется пользоваться биксами или специальными транспортировочными ящиками (контейнерами).
Каждая проба материала должна быть промаркирована, иметь соответствующее направление, а вся партия - заполненный сопроводительный лист. Во избежание инфицирования бланков направлений и сопроводительных документов желательно помещать их в чистый конверт или полиэтиленовый пакет и передавать непосредственно в руки водителю автотранспорта, не помещая их в транспортировочный контейнер. Категорически запрещается заворачивать флакон с материалом в бланк направления. Это необходимо объяснить больному и работнику, ответственному за сбор и транспортировку материала.
Перед отправлением транспортного средства, перевозящего материал, а также при приеме материала в лаборатории обязательна проверка следующих положений:
1. Число доставленных в лабораторию флаконов с материалом должно соответствовать их числу, указанному в сопроводительном листе.
2. Идентификационный номер пробы материала должен быть нанесен на этикетку или (боковую поверхность контейнера с материалом; не допускается нанесение маркировки на крышку флакона.
3. Идентификационный номер маркировки каждого флакона с материалом должен точно соответствовать номеру, указанному в сопроводительном листе.
4. Каждая проба материала должна иметь заполненный бланк направления с указанием характера необходимого исследования.
5. Каждая партия материала должна иметь сопроводительный лист, в котором должны быть указаны необходимые данные каждого пациента.
6. В сопроводительном листе должна быть указана дата, время отправки материала и подпись сотрудника, ответственного за отправку.
Сопроводительный лист составляется в 2 экземплярах: один заполненный экземпляр передается в лабораторию; другой - с подписью сотрудника, принявшего материал для исследования, возвращается в учреждение, направившее материал в лабораторию.
Г) АНАЛИЗ НА АТИПИЧНЫЕ КЛЕТКИ.
Мокрота собирается в чистую сухую банку. Банку с материалом следует сразу же доставить в цитологическую лабораторию, т.к. атипичные клетки быстро разрушаются.
- ИССЛЕДОВАНИЕ ПЛЕВРАЛЬНОЙ ЖИДКОСТИ.
В плевральной полости может быть экссудат и транссудат.
ЭКССУДАТ - воспалительная жидкость. ЭКССУДАТ бывает: серозный, гнойный, геморрагический, хилезный.
ТРАНССУДАТ - невоспалительная жидкость.
Критерии дифференциальной диагностики в таблице.
| № | критерии | транссудат | экссудат |
| 1. | плотность | менее 1015 | более 1015 |
| 2. | белок | менее 30 г/л | более 30 г/л |
| 3. | проба Ривальта | отриц. | полож. |
| 4. | клетки | лейкоциты менее 20 | лейкоциты более 20 |
Плевральную жидкость получают при плевральной пункции – проколе грудной клетки с помощью специальной иглы, при этом игла попадает в плевральную полость, шприцем берут на анализ необходимое количество плевральной жидкости и отправляют в лабораторию.
ПЛЕВРАЛЬНАЯ ПУНКЦИЯ- это диагностический / уточнение диагноза/ и лечебный / удаление экссудата, введение лекарств / метод при экссудативном плеврите.
Плевральная пункция – врачебная манипуляция. Фельдшер является помощником врача при проведении манипуляции. Проводится пункция в процедурном кабинете или в операционной.
Задачи фельдшера при плевральной пункции:
- Подготовка пациента (пункция проводится натощак, перед опорожнить мочевой пузырь и кишечник).
- Подготовка инструментария, медикаментов и необходимого медицинского оборудования.
- Доставка пациента для процедурный кабинет или в операционную.
- Создание положения пациента для пункции (сидя лицом к спинке стула, рука на стороне пункции заведена за голову, под грудь подложить валик или подушку).
- Подача врачу необходимых инструментов во время пункции.
- Наблюдение за состоянием пациента во время пункции.
- Оформление направления и доставка плевральной жидкости в лабораторию.
- Транспортировка пациента в палату и наблюдение после пункции.
- Обработка инструментария и материала после пункции.
Набор для плевральной пункции.
1. Корнцанг для обработки места прокола.
2. Стерильные салфетки для обработки места прокола.
3. Антисептик и стерильная емкость для антисептика.
4. Набор для местной анестезии: корнцанг, шприцы 5,0-10,0-20,0 по 2-3 шт, иглы разные по 2-3 шт, емкость для новокаина 200,0-300,0, новокаин 0,25% - 500,0.
5. Одноразовая система, включающая иглу плевральную с трубкой и зажимом, шприц Жане, емкость для сбора жидкости.
6. Пробирки.
7. Лейкопластырь.
8. Ножницы.
После пункции пациента доставляют в палату на каталке, в течение часа постельный режим и в течение суток наблюдение за состоянием.
Дата публикования: 2014-10-18; Прочитано: 6426 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
