 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Горение любого топлива — типичный пример окислительно-восстановительного процесса
|
|
ОКИСЛЕНИЕ ИЛИ ВОССТАНОВЛЕНИЕ?
Первую химическую реакцию человек провёл тогда, когда научился добывать огонь. С той поры и до настоящего времени реакции горения играют первостепенную роль в нашей жизни. Они приносят в дома тепло, двигают автомобили, самолёты и ракеты, помогают извлекать ценные вещества из природного сырья.
Флогистонная теория Шталя впервые выделила процессы горения и прокаливания металлов в отдельную группу реакций (см. статью «Химия в XVIII веке»). Кислородная теория горения, предложенная Лавуазье, обобщила экспериментальный материал, накопленный в «эпоху флогистона». А кроме того, Лавуазье выдвинул кислородную теорию кислот: он полагал, что своими свойствами кислоты обязаны присутствию в них кислорода (отсюда и название элемента oxygenium — «рождающий кислоты»). Поэтому реакции горения веществ на воздухе стали называть окислением, а
процессы, обратные окислению, т. е. связанные с уменьшением количества кислорода в веществе, — раскислением или восстановлением. Поскольку в ходе окислительных реакций вещество нередко разрушается (как, например, при ржавлении), термин «восстановление» указывает на процесс, противоположный окислению.
В дальнейшем представления о сущности процесса окисления значительно расширились. Как показали эксперименты, многие вещества (водород, металлы) горят не только в кислороде, но и в хлоре, броме. А значит, окисление — это не только присоединение кислорода. В 1914 г. русский учёный Лев Владимирович Писаржевский (1874—1938) предложил электронно-ионную теорию окислительно-восстановительных реакций.
В наши дни химикам известны тысячи самых разных окислительно-восстановительных реакций, в том числе и протекающих в живых орга-
КАКИЕ БЫВАЮТ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
Самый распространённый на Земле окислитель — кислород. Намного более сильным окислителем является озон О3 — аллотропная модификация кислорода. Он способен окислять многие вещества, которые с кислородом при обычных условиях не реагируют, например оксид азота(1\/): 2NO2+О3= N2O5+O2 и серебро: 2Ag+2О3=Ag2O2+2О2.
Наиболее сильный окислитель из числа простых веществ — фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и характера среды. Кроме него применяют также дихромат калия К2Сг2О7, азотную кислоту HNO3, пероксид водорода Н2О2, хлор С12, гипохлорит натрия NaClO. Очень сильные окислители — фториды благородных газов. Самый сильный из известных окислителей — фторид кислорода OF2.
Из восстановителей наиболее распространённый в природе — углерод. Его широко используют в промышленности для получения металлов из оксидов: Fe2O3+3С=2Fe+3СО; ZnO+С=Zn+CO.
Другой широко распространённый восстановитель — водород. Как и углерод, при нагревании он лег-
ко отнимает атомы кислорода у многих оксидов, превращаясь при этом в воду: СuО+Н2=Сu+Н2О; WO3+ЗН2=W+ЗН2О.
Очень сильными восстановителями являются щелочные и щёлочно-земельные металлы, алюминий. Они восстанавливают даже воду, вытесняя из неё водород: 2Na+2Н2О=2NaOH+Н2.
На практике восстановительными свойствами металлов пользуются для получения некоторых активных металлов из их оксидов и хлоридов. Так получают барий: ЗВаО+2Al=ЗВа+Аl2О3, стронций: 3SrO+2Al=3Sr + Al2O3, титан: TiCl4+2Mg=Ti+2MgCl2.
В лабораторных условиях восстановителями служат соединения, содержащие элементы в низких степенях окисления: сероводород H2S (S-2), иодоводородная кислота HI (I-), хлорид олова(II) SnCl2 (Sn+2). В органическом синтезе для восстановления обычно используют комплексные гидриды металлов: алюмогидрид лития LiAlH4 и борогидрид натрия NaBH4; они содержат водород в степени окисления -1.
Самый слабый восстановитель— фторид-ион F-. Окислить его до свободного фтора можно только с помощью электролиза или экзотических окислителей. Это объясняется с помощью теории сопряжённых окислителей и восстановителей.

При горении магниевой ленты на воздухе электроны от атомов магния переходят к атомам кислорода: 2Mg+О2=2MgO.
низмах. Можно с уверенностью говорить: химия жизни — это процессы окисления-восстановления.
ЧТО ЖЕ ТАМ ПРОИСХОДИТ?
В ходе химических превращений одни химические связи разрываются, а другие образуются, при этом во многих случаях изменяется вид электронного облака (т. е. распределение электронной плотности вокруг ядер атомов) в молекулах. Оно частично или полностью смещается от одних атомов к другим; атомы соответственно приобретают положительный или отрицательный заряд. Перераспределение электронной плотности и есть главный признак окислительно-восстановительного процесса.
Например, если молекула присоединяет атом кислорода, то между ним и одним из атомов в составе молекулы образуется химическая связь.
Электронная плотность такой связи смещена в сторону кислорода, который после фтора является самым электроотрицательным элементом. Это означает, что атом, связанный с кислородом, отдаёт ему часть своих электронов и тем самым приобретает частичный положительный заряд. Так, атом хлора в НС1 несёт частичный отрицательный заряд, а в НСlO4 — положительный, поскольку в первой молекуле электронная плотность смещена к атому хлора, а во второй — от него, к атомам кислорода.
В электронной теории окислительно-восстановительных реакций используют не реальные, а условные заряды атомов. Их рассчитывают, исходя из предположения, что все химические связи в молекуле имеют ионный характер и электронная плотность каждой связи полностью смещена к более электроотрицательному атому. Такие заряды называют степенями окисления. Степень окисления
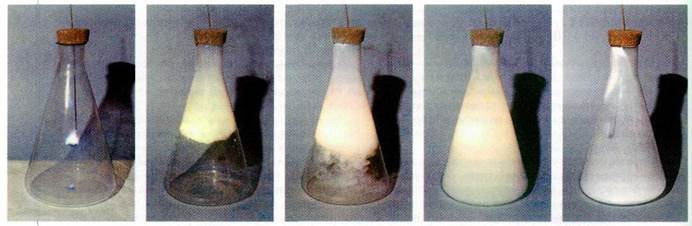
Горение красного фосфора в кислороде протекает очень интенсивно. За несколько секунд белый дым заполняет всю колбу. После окончания реакции на дне и стенках сосуда оседают мельчайшие кристаллики оксида фосфора(\/).

Дата публикования: 2014-11-18; Прочитано: 1894 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
