 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Участие ионов в различных средах
|
|
| Среда | В продукте больше атомов кислорода | В продукте меньше атомов кислорода |
| Кислая | Ион + Н2О → Ион + 2Н+ | Ион + 2Н+ → Ион + Н2О |
| Нейтральная | Ион + Н2О → Ион + 2Н+ | Ион + Н2О → Ион + 2ОН- |
| Щелочная | Ион + 2ОН- → Ион + Н2О | Ион + Н2О → Ион + 2ОН- |
SO3-2 + Н2О → SO4-2 + 2Н+
MnO4- + 2Н2О → MnO2 + 4ОН-
5. Уравниваем сумму зарядов в левой и правой части молекулярно-ионных схем ОВР. Находим коэффициенты (общий множитель), учитывая, что число отданных электронов равно числу принятых.Записываем электронно-ионное уравнение:
| SО3-2 + Н2О – 2e → SО4-2 + 2Н+ | окисление, восстановитель | |
| MnО4- + 2Н2О + 3е → MnО2 + 4ОН- | восстановление, окислитель |
6. Умножаем на коэффициенты все члены уравнений полуреакций и складываем:
3SO3-2 + 3Н2О + 2MnO4- + 4H2O → 2MnO2 + 3SO4-2 + 8OH- + 6Н+
приводим подобные члены: 8OH- + 6Н+ → 6Н2О + 2ОН-
3SO3-2 + 7Н2О + 2MnO4- → 2MnO2 + 3SO4-2 + 2OH- + 6Н2О
3SO3-2 + Н2О + 2MnO4- → 2MnO2 + 3SO4-2 + 2OH-
7. Подставляем коэффициенты в исходное уравнение:
3К2SO3 + 2KMnO4 + H2O → 2MnO2 + 3К2SO4 + 2KOH
Количественные характеристики окислительно-восстановительной способности элемента для определения направления протекания ОВР:
1. Энергия Гиббса (ΔG<0).
2. Электродный потенциал.
При погружении любого металла в раствор электролита на границе раздела металл-раствор возникает разность потенциалов, называемая электродным потенциалом.
Механизм возникновения электродного потенциала.
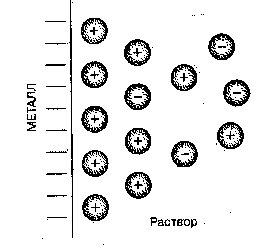
В узлах кристаллической решетки металлов находятся ионы. При погружении ее в раствор электролита ионы ее поверхностного слоя под действием анионов отрываются и переходят в раствор.
Ме0 ↔ Меп+ + пе
Вследствие этого раствор в непосредственной близости к пластинке заряжается положительно.
Меп+ + пН2О ↔ Меп+· пН2О
металл раствор
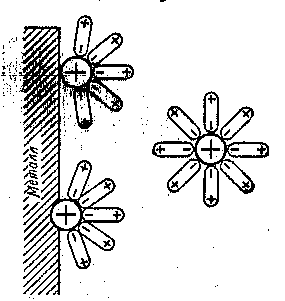
| Рис. 25. Возникновение электродного потенциала |
| Рис. 24. Возникновение двойного электрического слоя на границе металл-раствор. |
Переход ионов металла в раствор создает в самой пластинке металла избыток свободных электронов, придающих ей отрицательный заряд (рис 24).
Благодаря возникновению на металлической пластинке отрицательного заряда она начинает притягивать обратно из раствора положительно заряженные ионы. На границе раздела фаз устанавливается равновесие:
(восстановление) Ме0 + пН2О ↔ Меп+·пН2О + пе (окисление)
раствор кристал
Возникает двойной электрический слой. Вследствие его возникновения между металлом и раствором возникает разность (скачек) потенциала (электродный потенциал) (рис. 25).
Электродный потенциал (Е) характеризует способность атома отдавать свои валентные электроны, т.е. восстановительную активность.
Абсолютное значение электродного потенциала найти нельзя. Находят относительные значения по отношению к водороду (эталон, стандарт)
( ). Е окисленная форма/восстановленная форма (В)
). Е окисленная форма/восстановленная форма (В)
Потенциал, измеренный при стандартных условиях, называется стандартным электродным потенциалом (Е0).
По своей химической активности вещества располагаются в ряд, который называется рядом напряжений (ряд стандартных электродных потенциалов) (см. прил. 5, табл. 40, рис. 26).
Таблица 40
Дата публикования: 2014-11-18; Прочитано: 648 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
