 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
В Периодической системе Д.И. Менделеева
|
|
1. Укажите название элемента, его обозначение. Определите порядковый номер элемента, номер периода, группу, подгруппу. Укажите физический смысл параметров системы – порядкового номера, номера периода, номера группы. Обоснуйте положение в подгруппе.
2. Укажите количество электронов, протонов и нейтронов в атоме элемента, заряд ядра, массовое число.
3. Составьте полную электронную формулу элемента, определите электронное семейство, отнесите простое вещество к классу металлов или неметаллов.
4. Изобразите графически электронную структуру элемента (или двух последних уровней).
5. Укажите число и тип валентных электронов.
6. Графически изобразите все возможные валентные состояния.
7. Перечислите все возможные валентности и степени окисления.
8. Напишите формулы оксидов и гидроксидов для всех валентных состояний. Укажите их химический характер (подтвердите ответ уравнениями соответствующих реакций).
9. Приведите формулу водородного соединения.
10. Назовите область применения данного элемента
Решение. В ПСЭ элементу с порядковым номером 21 соответствует скандий  .
.
1. Элемент находится в IV периоде. Номер периода означает число энергетических уровней в атоме этого элемента, у него их 4. Скандий расположен в 3-й группе – на внешнем уровне 3 электрона; в побочной подгруппе. Следовательно, его валентные электроны находятся на 4s- и 3d- подуровнях. Является d-элементом. Порядковый номер численно совпадает с зарядом ядра атома.
2. Заряд ядра атома скандия +21.
Число протонов и электронов - по 21.
Число нейтронов А-Z= 45-21=24.
Общий состав атома:  (
( ).
).
3. Полная электронная формула скандия:
 1s2 2s2 2p6 3s2 3p6 3d1 4s2 или в сокращенной форме: [Sc] 3d1 4s2
1s2 2s2 2p6 3s2 3p6 3d1 4s2 или в сокращенной форме: [Sc] 3d1 4s2
Электронное семейство: d-элемент, так как в стадии заполнения d-орбитали. Электронное строение атома заканчивается s- электронами, поэтому скандий проявляет металлические свойства; простое вещество – металл.
4. Электронно-графическая конфигурация  имеет вид:
имеет вид:
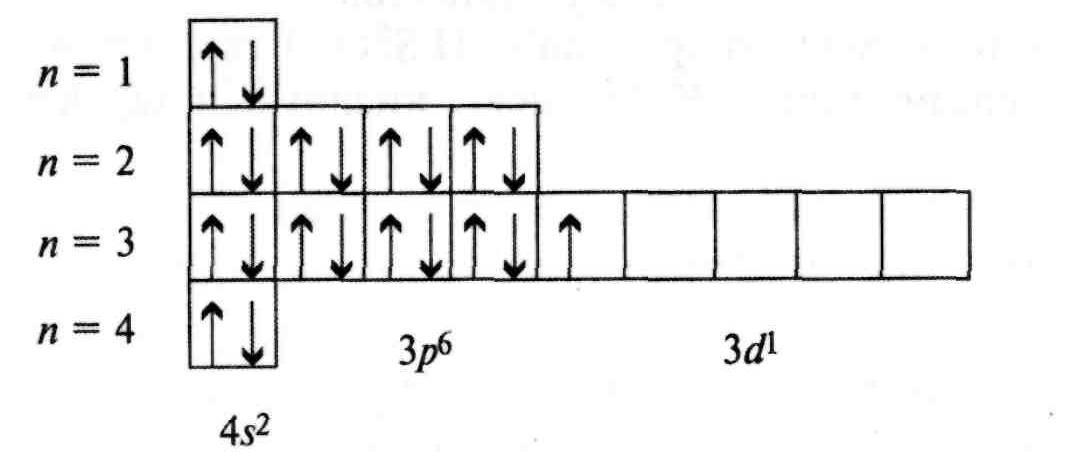
5. Он имеет в возбужденном состоянии три валентных электрона (два на 4s- и один на 3d- подуровне)
6. Возможные валентные состояния, обусловленные числом неспаренных электронов:
- в основном состоянии:
s p d
| n = 3 |
f
| n = 4 |
- в возбужденном состоянии:
s p d
| n = 3 |
f
| n = 4 |
спинвалентность равна 3 (один неспаренный d-электрон и два неспаренных s-электрона)
7. Возможные валентности в данном случае определяются числом неспаренных электронов: 1, 2, 3 (или I, II, III). Возможные степени окисления (отражают число смещенных электронов) +1, +2, +3. Наиболее характерные и устойчивая валентность III, степени окисления +3. Наличие лишь одного электрона в d- состоянии обуславливает малую устойчивость d1s2- конфигурации. Скандий и его аналоги, в отличие от других d-элементов проявляет постоянную степень окисления +3, это высшая степень окисления и соответствует номеру группы.
8. Формулы оксидов и их химический характер: форма высшего оксида – Sc2O3 (амфотерный).
Формулы гидроксидов: Sc(OH)3 – амфотерный.
Уравнения реакций, подтверждающих амфотерный характер оксидов и гидроксидов:
Sc(OH)3 +3 КОН = К3[Sc(OH)6] (гекса гидроксоскандиат калия )
2 Sc(OH)3 + 3 Н2SO4 = 6 Н2О + Sc2(SO4)3 (сульфат скандия)
9. Соединения с водородом не образует, так как находится в побочной подгруппе и является d-элементом.
10. Соединения скандия применяются в полупроводниковой технике.
Пример 6. У какого из двух элементов марганца или брома сильнее выражены металлические свойства?
Решение. Данные элементы находятся в четвертом периоде. Записываем их электронные формулы:
25 Mg 1s22s22p63s23p64s23d5
35 Br 1s22s22p63s23p64s23d104p5
Марганец – d-элемент, то есть элемент побочной подгруппы, а бром – р-элемент главной подгруппы этой же группы. На внешнем электронном уровне у атома марганца только два электрона, а у атома брома – семь. Радиус атома марганца меньше радиуса атома брома при одинаковом числе электронных оболочек.
Общей закономерностью для всех групп, содержащих р- и d-элементы является преобладание металлических свойств у d-элементов. Таким образом, у марганца металлические свойства выражены сильнее, чем у брома.
Пример 7. Какой из двух гидроксидов является более сильным основанием а) Sr(OH)2 или Ba(OH)2; б) Ca(OH)2 или Fe(OH)2 в) Sr(OH)2 или Cd(OH)2?
Решение. Чем больше заряд и чем меньше радиус иона, тем сильнее удерживает он другие ионы. В этом случае гидроксид будет более слабым, так как у него меньше способность к диссоциации.
а) Для ионов одинакового заряда со сходным электронным строением радиус, тем больше, чем больше электронных слоев содержит ион. Для элементов главных подгрупп (s- и р-) радиус у ионов увеличивается с увеличением порядкового номера элемента. Следовательно, Ba(OH)2 является болеесильным основанием, чем Sr(OH)2.
б) В пределах одного периода радиусы ионов уменьшаются при переходе от s- и р-элементов к d-элементам. При этом число электронных слоев не меняется, а заряд ядра увеличивается. Поэтому основание Ca(OH)2 более сильное, чем Fe(OH)2.
в) Если элементы находятся в одном периоде, в одной группе, но в разных подгруппах, то радиус атома элемента главной подгруппы больше радиуса атома элемента побочной подгруппы. Отсюда, основание Sr(OH)2 сильнее, чем Cd(OH)2.
Пример 8. Каким типом гибридизации АО азота описывается образование иона  и молекулы NH3? какова пространственная структура этих частиц?
и молекулы NH3? какова пространственная структура этих частиц?
Решение. Как в ионе аммония, так и в молекуле аммиака валентный электронный слой атома азота содержит четыре электронных пары. Поэтому в обоих случаях электронные облака атома азота будут максимально удалены друг от друга при sр3-гибритизации, когда их оси направлены к вершинам тетраэдра. При этом в ионе  все вершины тетраэдра заняты атомами водорода, так что этот ион имеет тетраэдрическую конфигурацию с атомом азота в центре тетраэдра.
все вершины тетраэдра заняты атомами водорода, так что этот ион имеет тетраэдрическую конфигурацию с атомом азота в центре тетраэдра.
При образовании молекулы аммиака атомы водорода занимают только три вершины тетраэдра, а к четвертой вершине направлено электронное облако неподеленной электронной пары атома азота. Образовавшаяся фигура при этом – тригональная пирамида с атомом азота в ее вершине и атомами водорода в вершинах основания.
Пример 9. Объясните с позиций метода МО возможность существования молекулярного иона  и невозможность существования молекулы Не2.
и невозможность существования молекулы Не2.
Решение. В молекулярном ионе  имеются три электрона. Энергетическая схема образования этого иона с учетом принципа Паули показана на рис.21.
имеются три электрона. Энергетическая схема образования этого иона с учетом принципа Паули показана на рис.21.

Рис. 21. Энергетическая схема образования иона  .
.
На связывающей орбитали размещены два электрона, а на разрыхляющей – один. Следовательно, кратность связи в этом ионе равна (2-1)/2 = 0,5, и он должен быть энергетически устойчивым.
Напротив, молекула Не2 должна быть энергетически неустойчивой, поскольку из четырех электронов, которые должны разместиться на МО, два займут связывающую МО, а два – разрыхляющую. Следовательно, образование молекулы Не2 не будет сопровождаться выделением энергии. Кратность связи в этом случае равна нулю – молекула не образуется.
Пример 10. Какая из молекул – В2 или С2 характеризуется более высокой энергией диссоциации на атомы? Сопоставьте магнитные свойства этих молекул.
Решение. Составим энергетические схемы образования данных молекул (рис. 22).

Рис. 22. Энергетическая схема образования молекул В2 и С2.
Как видно, в молекуле В2 разность между числом связывающих и числом разрыхляющих электронов равна двум, а в молекуле С2 – четырем; это отвечает кратности связи соответственно 1 и 2. Следовательно, молекула С2 . характеризующаяся более высокой кратностью связи между атомами, должна быть более прочной. Этот вывод соответствует экспериментально установленным значениям энергии диссоциации на атомы молекул В2 (276 кДж/моль) и С2 (605 кДж/моль).
В молекуле В2 два электрона расположены, согласно правилу Гунда, на двух πсв 2р-орбиталях. Наличие двух неспаренных электронов сообщает этой молекуле парамагнитные свойства. В молекуле С2 все электроны спарены, следовательно, эта молекула диамагнитна.
Пример 11. Как располагаются электроны по МО в молекуле CN и в молекулярном ионе CN -, образующемся по схеме: C- + N → CN -. В какой из этих частиц длина связи наименьшая?
Решение. Составив энергетические схемы образования рассматриваемых частиц (рис. 23), заключаем, что кратность связи в CN и CN- соответственно равна 2,5 и 3. Наименьшей длиной связи характеризуется ион CN -, в котором кратность связи между атомами наибольшая.
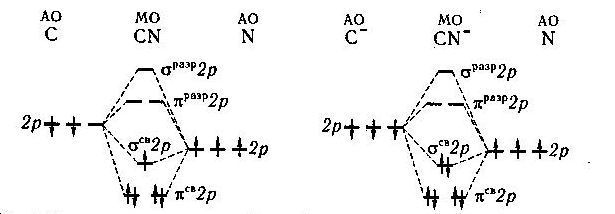
Рис. 23. Энергетические схемы
образования молекулы CN и молекулярного иона CN -.
Пример 12. Какой тип кристаллической решетки характерен для твердого простого вещества, образованного элементом с порядковым номером 22?
Решение. По ПСЭ Д.И. Менделеева определяем элемент с данным порядковым номером и составляем его электронную формулу.
Титан  1s22s22p63s23p64s23d2
1s22s22p63s23p64s23d2
Титан является d-элементом, на внешнем уровне содержит два электрона. Является типичным металлом. В кристалле титана между атомами, имеющими на внешнем валентном уровне два электрона, возникает металлическая связь. Энергия кристаллической решетки ниже энергии решетки ковалентных кристаллов, но значительно выше, чем у молекулярных кристаллов. Кристалл титана обладает высокой электро- и теплопроводностью, способен деформироваться без разрушения, обладает характерным металлическим блеском, имеет высокую механическую прочность и температуру плавления.
Пример 13. Чем отличается структура кристалла CaF2 от структуры кристаллов Са и F2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет, а их свойства?
Решение.  1s22s22p63s23p64s2 Са – типичный металл, s-элемент, имеет на внешнем энергетическом уровне два валентных электрона. Образует металлическую кристаллическую структуру с выраженным металлическим типом связи. Обладает металлическим блеском, электро- и теплопроводностью, пластичен.
1s22s22p63s23p64s2 Са – типичный металл, s-элемент, имеет на внешнем энергетическом уровне два валентных электрона. Образует металлическую кристаллическую структуру с выраженным металлическим типом связи. Обладает металлическим блеском, электро- и теплопроводностью, пластичен.
 1s22s22p5 F2 – типичный неметалл, р-элемент, на внешнем энергетическом уровне имеет только один неспаренный электрон, что недостаточно для образования прочных ковалентных кристаллов. Атомы фтора связаны ковалентной связью в двухатомные молекулы, которые образуют молекулярный кристалл за счет сил межмолекулярного взаимодействия. Он непрочен, легко возгоняется, обладает низкой температурой плавления, изолятор.
1s22s22p5 F2 – типичный неметалл, р-элемент, на внешнем энергетическом уровне имеет только один неспаренный электрон, что недостаточно для образования прочных ковалентных кристаллов. Атомы фтора связаны ковалентной связью в двухатомные молекулы, которые образуют молекулярный кристалл за счет сил межмолекулярного взаимодействия. Он непрочен, легко возгоняется, обладает низкой температурой плавления, изолятор.
При образовании кристалла CaF2 между атомами Са и F образуется ионная связь, поскольку разница в электроотрицательности между ними достаточно велика DЭО=4 (табл. 14). Это приводит к образованию ионного кристалла. Вещество растворимо в полярных растворителях. При обычных температурах является изолятором, при повышении температуры усиливаются точечные дефекты кристалла (за счет теплового движения ионы покидают узлы кристаллической решетки и переходят в междоузлия или на поверхность кристалла). Когда кристалл попадает в электрическое поле, наблюдается направленное перемещение ионов к вакансии, образованные ушедшим ионом. Тем самым обеспечивается ионная проводимость кристалла CaF2.
Дата публикования: 2014-11-18; Прочитано: 4733 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
