 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Гомологічний ряд насичених одноосновних кислот
|
|
Загальна формула членів гомологічного ряду насичених одноосновних карбонових кислот CnH2n+1COOH, де n= 0, 1,2, 3....
Номенклатура. Назви карбонових кислот за замісниковою номенклатурою будують з назви відповідного алкану з додаванням закінчення -ова і слова «кислота». Якщо вуглецевий ланцюг розгалужений, то па початку назви кислоти записують замісник, зазначаючи його положення в ланцюгу. Нумерацію атомів вуглецю в ланцюгу починають з вуглецю карбоксильної групи. Приклади:


2 4 Диметрилпентанова 3 4 4 5 Тетраметилгексанова
(2 4 диметилвалеріанова (3 4 4 5 тетраметилкапронова
кислота) кислота)
Для деяких членів гомологічного ряду насичених карбонових кислот застосовують тривіальні назви. В табл. 26.1 наведено формули деяких насичених одноосновних кислот і їх назви за замісниковою номенклатурою та тривіальні назви.
Таблиця 26.1 Деякі насичені одноосновні кислоти
| Формула | Назва | |
| за замісниковою номенклатурою | тривіальна | |
| НСOOH | Метанова | Мурашина |
| СН3СООН | Етанова | Оцтова |
| С2Н5СООН | Пропанова | Пропюнова |
| С3Н7СООН | Бутанова | Масляна |
| С4Н9СООН | Пектанова | Валеріанова |
| С5Н11СООН | Гексанова | Капронова |
| С6Н13СООН | Гегтганова | Енантова |
| С15Н31СООН | Пентадеканова | Пальмітинова |
| С16Н33СООН | Гексадєканова | Маргаринова |
| С17Н35СООН | Гептадеканова | Стеаринова |
Iзомери. Починаючи з бутанової кислоти С3Н7СООН, члени гомологічного ряду насичених одноосновних кислот мають ізомери, їх ізомерія зумовлена розгалуженістю вуглецевого ланцюга вуглеводневих радикалів. Так, бутанова кислота має такі два ізомери (у дужках дано тривіальну назву):

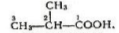
Бутанова(масляна)кислота 2-Метилпропанова(ізомасляна)кислота
Властивості насичених одноосновиих кислот. Кислоти гомологічного ряду з нормальною будовою від мурашинної до С8НІ7СООН за звичайних умов – безбарвні рідини, що мають різкий запах. Вищі члени ряду, починаючи з С9Н19СООН,- тверді речовини. Мурашина, оптова і проліонова кислоти добре розчиняються в воді в будь-яких співвідношеннях. Інші рідкі кислоти обмежено розчиняються у воді. Тверді кислоти у воді практично нерозчинні.
Особливості хімічних властивостей карбонових кислот зумовлені сильними взаємним впливом карбонільної С=0 і гідроксильної ОН-груп. У карбоксильній групі зв'язок між вуглецем й карбонільним киснем сильнополярний. Проте позитивний заряд на атомі вуглецю частково зменшується внаслідок притягання електронів атома кисню гідроксильної групи. Тому в карбонових кислотах карбонільний вуглець менш схильний до взаємодії з нуклеофільними частинками, ніж в альдегідах і кетонах. З іншого боку, під впливом карбонільної групи підсилюється полярність зв'язку О-Н за рахунок зміщення електронної густини від кисню до атома вуглецю. Всі зазначені особливості карбоксильної групи можна проілюструвати такою схемою:
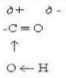
Розглянутий характер електронної будови карбоксильної групи зумовлює відносну легкість відщеплення атома водню цієї групи. Тому у карбонових кислот добре виявленні кислотні властивості. У безводному стані і особливо у водних розчинах карбонові кислоти дисоціюють на іони:
СН3 - СН2 - СООН ↔ СН3 - СН2 – СOO- + H+.
Кислотний характер розчинів карбонових кислот можна встановити за допомогою індикаторів. Карбонові кислоти є слабкими електролітами, причому сила карбонових кислот зменшується зі збільшенням молекулярної маси кислоти.
Для насичених одноосновних кислот найбільш характерні реакції, зумовлені кислотними властивостями, а також реакції заміщення гидроксильної групи.
1. Взаємодія з металами. Карбонові кислоти реагують з деякими металами з утворенням солей і водню, наприклад: 2СH3СООН + Мg → Мg(СНзСОО)2 + Н2
2.Взаємодія з основними оксидами і основами. Як усі кислоти, карбоксильні сполуки реагують з основними оксидами і основами, наприклад:
2С2Н5СООН + МgО → Мg(С2Н5СОО)2 + Н20;
С2Н,СООН + КОН → С2Н5СООК + Н20
з водним розчином аміаку, який виявляє властивості основ, карбонові кислоти також утворюють солі: С2Н5СООН + КН3→ С2Н5СООNH4,.
3.Взаємодія зі спиртами. Карбонові кислоти реагують зі спиртами при наявності сильних неорганічних кислот. Від молекули кислоти відщеплюється група ОН, від молекули спирту - атом Н, в результаті утворюються складні ефіри:
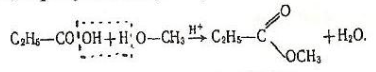
Метилпропіонат
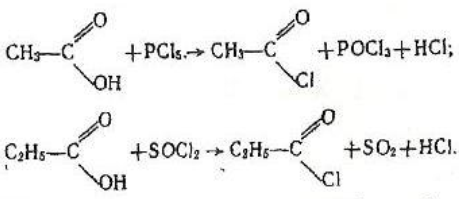
4.Взаємодія з галогенідами фосфору і сірки. Галогеніди фосфору (РBr3, РСІ3) і сірки (SОС12) взаємодіють з карбоновими кислотами, утворюючи хлорангідриди кислот, наприклад:
5.Взаємодія з водовідбірними агентами. Під дією сильних водовідбірних речовин, наприклад Р203 на карбонові кислоти утворюються ангідриди кислот:
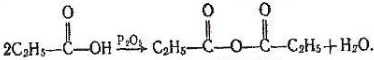
Пропіоновий антідрид
6.Взаємодія з галогенами. Як і в альдегідах, хлор і бром можуть заміщувати атом водню біля другого вуглецевого атома з утворенням галогенозаміщених кислот, наприклад:
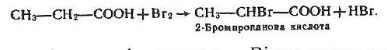
7.Відновлення і каталітичне гідрування. Відновлюючи карбонові кислоти, можна добути альдегіди і первинні спирти, наприклад:

Відновлення кислот відбувається дуже важко.
Добування насиченнх одноосновних кислот. Основні методи добування карбонових кислот такі.
1. Окислення первинних спиртів і альдегідів. Спирти і альдегіди окислюються досить легко, наприклад:
O
║
С2H5-C+[O]→C2H5COOH
│
H
Під час окислення кетонів, вторинних і третинних спиртів у жорстких умовах (сильні окислювачі, нагрівання) відбувається розщеплення вуглецевого ланцюга молекул і утворюється, як правило, суміш карбонових кислот. Наприклад, окислюючи ацетон, можна добути суміш мурашиної і оцтової кислот.
2. Окислення алканів. Суміш нижчих алканів (бутан-октан) окислюється при наявності каталізаторів переважно до оцтової кислоти. Алкани, що містять 9-20 вуглецевих атомів, окислюються до вищих кислот.
3. Гідроліз нітрилів. Нітрили - сполуки типу R— С=N. Під час нагрівання нітрилів з водою, в яку добавлено неорганічні кислоти, утворюються карбонові кислоти, наприклад:
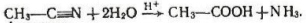
Ацетонiтрил
4. Карбонілування алкенів. Кислоти, починаючи з пропіонової. можна добути приєднанням оксиду вуглецю (II) і води до алкенів. Каталізатором реакції є фосфорна кислота, процес відбувається при температурі 300-350°С і тиску 20-30 МПа. Наприклад:
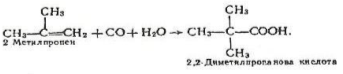
2 Метилпропен 2,2 – Диметилпропанова кислота
Дата публикования: 2014-11-18; Прочитано: 9583 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
