 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Двохосновні карбонові кислоти
|
|
Насичені двохосновні кислоти. Молекули двохосновних карбонових кислот містять дві карбоксильні групи. Найпростіша двохосновна кислота – щавелева – це сполучення двох карбоксильних груп:
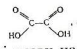 , або НООС-СООН
, або НООС-СООН
За міжнародною номенклатурою назви насичених двохосновних кислот будують з назви відповідного алкану з додаванням закінчення – діова. Найбільш застосовні для цих кислот тривіальні назви. В табл. наведені деякі найбільш поширені насичені двохосновні кислоти.
| НООС-СООН Етандінова Щавелева |
| НООС-СН 2 –СООН Пропандінова Малонова |
| НООС-СН 2 –СН 2- СООН Бутандіова Янтарна |
| НООС-(СН 2) 3 –СООН Пентандіова Глутарова |
| НООС-(СН 2)4 – СООН Гександіова Адипінова |
Щавелева кислота - це безбарвна кристалічна речовина, розчинна у воді. Виділяється з водних розчинів у вигляді кристалогідрату Н2С2О4 • 2Н20.
Найважливіший метод добування щавелевої кислоти заснований на нагріванні до 400°С - форміату натрію (сіль мурашиної кислоти). В результаті цього процессу утворюється натрієва сіль щавелевої кислоти - оксалат натрію:

Дією неорганічних кислот на оксалат натрію добувають щавелеву кислоту. Щавелева кислота утворюється також під час окислення багатьох органічних речовин: етилену, етиленгліколю, сахарів, деревини. У водному розчині шавелева кислота дисоціює на іони, причому як двохосновна кислота ступінчасто:
Iступінь НООС-СООН = Н++НООС-СОО-
IIступінь НООС-СОО- -= Н++-ООС-СОО2-
Щавелева кислота - одна з найсильніших карбонових кислот, її дисоціація відбувається переважно за першим ступенем. Щавелева кислота виявляє багато хімічних властивостей, характерних для карбонових кислот. При цьому в реакцію можуть вступати як одна, так і дві карбоксильні іруни, наприклад:
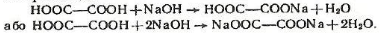
Щавелева кислота виявляє і особливі властивості. Так, вона легко окислюється перманганатом в кислому середовищі;

Під час нагрівання щавелева кислота розкладається:
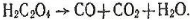
Солі щавелевої кислоти – оксалати, наприклад К2С2О4 – оксалат калію. Оксалати трапляються в природі. Щавелеву кислоту застосовують для очистки металів від продуктів корозії, накипу та інших забруднень. Її використовують також як протраву при вичинці шкіри.
Милами називаються солі високомолекулярних карбонових кислот, розчини яких мають миючі властивості. Для добування мила жир або суміш жирних кислот, у тому числі добутих синтетичним шляхом, оброблюють при кип’ятінні розчином їдкого натра (варка мила). При цьому відбувається гідроліз гліцеридів та нейтралізація утворених жирних кислот. Добутий продукт отримав назву мильного клею. Після його охолодження та розділки добувають клеєне мило. Для добування ядрового мила до мильного клею додають концентрований розчин повареної солі (висолювання); утворюються два шари, верхній шар - ядро, після відділення, промивки та охолодження є високоякісним милом. Властивості мил залежать від складу жирних кислот, солі ненасичених кислот мають більшу розчинність, чим насичені. Рідкі мила - це калієві солі вищих жирних карбонових кислот, а тверді мила- це натрієві солі вищих жирних карбонових кислот.
Складні ефіри - це речовини, які мають загальну формулу R - О - R', де R і R'-
вуглеводневі радикали. Складні ефіри утворюються під час взаємодії карбонових кислот зі спиртами, наприклад:
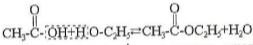
При відщепленні молекули води від молекули кислоти відщеплюється гідроксильна група, а атом водню - від спирту. Отже, складні ефіри - це похідні кислот, у яких гідроксильна група замінена на групу - О R' спирту.
За сучасною міжнародною номенклатурою назву ефіру будують з назви вуглеводного радикалу, що відповідає спирту, і кореня латинської назви кислоти з додаванням закінчення -ат. Застосовують також назви, які складаються з назв спирту і кислоти, шо утворюють ефір. Приклади:

Етилформіат Етилацетат(етиловий
(етиловий ефір ефір оцтової кислоти)
Мурашиної кислоти)
Реакція добування складного ефіру з кислоти і спирту називається етерифікацією. Ця реакція оборотна. Для зміщення рівноваги в бік утворення складного ефіру необхідна наявність сильних неорганічних кислот. Розглянемо коротко механізм реакції етерифікації. Спочатку іони водню (від неорганічної кислоти) взаємодіють з карбонільним киснем кислоти з утворенням карбокатіона, який потім реагує з молекулою спирту:

Для добування складних ефірів крім реакції етерифікації можна використати реакції ангідридів і хлорангідридів кислот зі спиртами, наприклад:
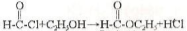
Етилформіат

Метилпропіонат
Ненасичені та ароматичні кислоти також утворюють сладні ефіри, наприклад:

Етилакрилат(етиловий ефір Метилбензоат(метиловий
Акрилової кислоти) ефір бензойної кислоти)
Двохосновні карбонові кислоти можуть утворювати моно- та діефіри; наприклад, терефталева кислота має такі складні ефіри:
НООС  СО-ОСН3 СНзО-СО
СО-ОСН3 СНзО-СО  СО-ОСН3
СО-ОСН3
Метилтерефталат Диметилтерефталат
Сладні ефіри можна добути і для неорганічних кислот. Так, сірчана кислота з метанолом дає два складних ефіри:

Метилсульфат Диметилсульфат
Сладним ефіром азотної кислоти і гліцерину є тринітрогліцерин

Складні ефіри найпростіших кислот і спиртів - рідини, більшість з яких має приємний запах, наприклад, для ізо- пентилацетату характерний запах груші, бутилфенілацетату - запах меду. Багато складних ефірів міститься у квітах, ягодах, фруктах, надаючи їм характерного аромату.
Складні ефіри є хорошими розчинниками багатьох органічних речовин, у тому числі полімерів.
Найбільш характерною хімічною реакцією складних ефірів є розкладання їх водою (гідроліз):

Ця реакція (зворотна етерифікації) називається реакцією омилення. Практично необоротна реакція омилення складних ефірів відбувавається при наявності лугів. Складні ефіри застосовують у харчовій промисловості для приготування фруктових вод і есенцій, кондитерських виробів, а також парфюмерних виробів.
Етилацетат (етиловий ефір оцтової кислоти) СН3СООС2Н5 - це безбарвна рідина з характерним запахом. Кипить при температурі 77,2°С. Незначною мірою розчиняється у воді. У промисловості етилацетат добувають за реакцією етерифікації між етанолом і оцтовою кислотою. Етилацетат застосовують переважно як розчинник органічних речовин, у тому числі полімерів. Він входить до складу харчових фруктових есенцій і парфюмерних виробів (мила).
Діетилмалонат (малоновий ефір) С2Н5ОСО-СН2-СООС2Н5 - ефір двохосновної малонової кислоти. Це рідина з приємним фруктовим запахом. У малоновому ефірі атоми водню середньої групи -СН2- дуже рухливі: вони можуть бути заміщені на метал (натрій):
2С2Н5ОСО-СН2-СООС2Н5+2Na2→(С2Н5ОСО-СН-СООС2Н5)Na++Н2.
Його добувають за реакцією етерифікації між малоновою кислотою і етанолом. Малоновий ефір використовують в органічному синтезі.
Метилметакрилат (метиловий ефір метакрилової кислоти) СН2=С(СН3)-СООСН3 добувають етерифікацією метакрилої кислоти з метанолом. Завдяки наявності подвійного зв'язку цей ефір може полімеризуватися з утворенням поліметилметакрилату:

Поліметилметакрилат - прозора безбарвна скловидна речовина. Має високу міцність, добре обробляється. Прозорі листи поліметилметакрилату називають органічним склом. Воно переважає за міцністю звичайне скло і застосовується як замінник скла в різних галузях техніки.
Практичне застосування знаходять співполімери метилметакрилату з іншими органічними речовинами. Поліметилметакрилат та полімери інших ефірів метакрилової кислоти (етилового, «-бутилового) входять до складу лаків і клеїв.
Диметилтерефталат (диметиловий ефір терефталевої кислоти) СН3ОСО-С6Н4СООСН3 добувають етерифікацією терафталевої кислоти метанолом. Це безбарвна кристалічна речовина.
Диметилтерефталат є вихідним реагентом для добування технічно важливого полімеру - поліетилентерефталату. Виробництво цього полімеру складається з двох основних стадій. Ефір нагрівають з етиленгліколем, потім утворений етиленгліколевий ефір терефталевої кислоти піддають поліконденсації:

З поліетилентерефталату виробляють штучне волокно лавсан. Лавсан має високу міцність, стійкість проти стирання та дії хімічних речовин. З нього виробляють міцні технічні тканини. В текстильній промисловості використовують суміш лавсаного волокна з вовною.
Ліпіди - це речовини, що входять до складу тваринних і рослинних тканин і є похідними вищих карбоновних кислот, спиртів та інших сполук. Ліпіди діляться на дві великі групи: прості і складні ліпіди. Прості ліпіди не містять азоту, фосфору і сірки. До них у першу чергу відносяться нейтральні ліпіди, які є похідними вищих жирних кислот і одно- чи багатоатомних спиртів. У склад складних ліпідів входять фосфоліпіди, сульфоліпіди, сфінголіпіди.
Жири є різновидом класу природних органічних сполук, які називаються ліпідами. За хімічною будовою жири - складні ефіри гліцеріну і вищих карбонових кислот їх називають також тригліцеридами.
Число вуглецевих атомів у кислотах, шо входять до сладу жирів, як правило, більше восьми (іноді менше). Приклади жирів:

Тригліцерид Тригліцерид
Гальцимітинової кислоти алеїнової кислоти
Тригліцериди насичених кислот за звичайних умов є твердими речовинами, Важливою хімічною властивістю жирів є їх здатність гідролізуватися, тобто всупати в реакцію омилення. Наприклад, під час омилення змішанного гліцериду, шо містить залишки пальмітинової (С15Н31СООН) і стеаринової (С17Н35СООН) кислот, виділяються гліцерин і ці кислоти:

Омилення жирів відбувається необоротно при наявності лугів, при цьому утворюються гліцерин і сіль кислоти. Жири широко поширені в природі, вони є складовою частиною рослинних і тваринних організмів. Тригліцериди можна добути за реакцією етерифікації, проте в промисловості їх виділяють переважно з природних речовин. У тваринних жирах переважають тригліцериди насичених кислот, тому ці жири за звичайних умов є твердими речовинами (наприклад, вершкове масло, сало). У рослинних жирах переважають тригліцериди ненасичених кислот, ці жири є рідинами (соняшникова олія, маслинова олія). Такі жири називаються оліями. У промисловості рідкі рослинні олії часто переробляють на тверді жири, які за властивостями нагадують тваринні. Для цього рослинні олії піддають каталітичному гідруванню, наприклад:

З гідрованих рослинних жирів виробляють важливий харчовий продукт - маргарин, який за хімічним складом аналогічний тваринним жирам. Жири є важливою складовою частиною продуктів харчування людини і тварин. У процесі травлення відбувається гідроліз жирів, продукти гідролізу всмоктуються тканинами кишок. В ораганізмі продукти гідролізу жирів знов утворюють потрібні жири. Жири в організмі людини і тварин постійно замінюються новими в процесі обміну речовин. Відпрацьовані жири поступово окислюються до вуглекислого газу і води.
Жири мають широке застосування в промисловості. Вони є вихідними речовинами для добування мила і гліцерину, використовуються для приготування мастил, косметичних засобів, розчинників олійних фарб - оліф. Крім жирів до ліпідів належать воски - складні ефіри вищих карбонових кислот і виших спиртів. Наприклад, воском є ефір метилового спирту (С15Н31СН2ОН) і пальмітинової кислоти С15Н31СООС15Н31. Цей воск входить до складу бджолиного воску і речовини спермацету, що міститься в голові кита.
Дата публикования: 2014-11-18; Прочитано: 16755 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
