 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Механизм гомогенного и гетерогенного катализа
|
|
Механизм гомогенного катализа обычно объясняют с помощью теории промежуточных соединений. Согласно этой теории, катализатор (K) сначала образует с одним из исходных веществ промежуточное соединение АK, которое реагирует с другим исходным веществом с восстановлением катализатора. Схематически это можно представить так:
А + Б = АБ (реакция протекает медленно в отсутствии катализатора)
В присутствии катализатора процесс разбивается на 2 стадии:
1) А + K = АK (протекает быстро)
2) АK + Б = АБ + К (протекает быстро)
Энергия активации каждой из этих двух стадий меньше энергии активации некаталитической реакции (рис. 46).
Конкретным примером гомогенного катализа может служить реакция окисления SO2 в SO3 в присутствии катализатора NO.
Без катализатора реакция даже при нагревании практически не идет:
2SO2 + O2 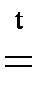 2SO3
2SO3
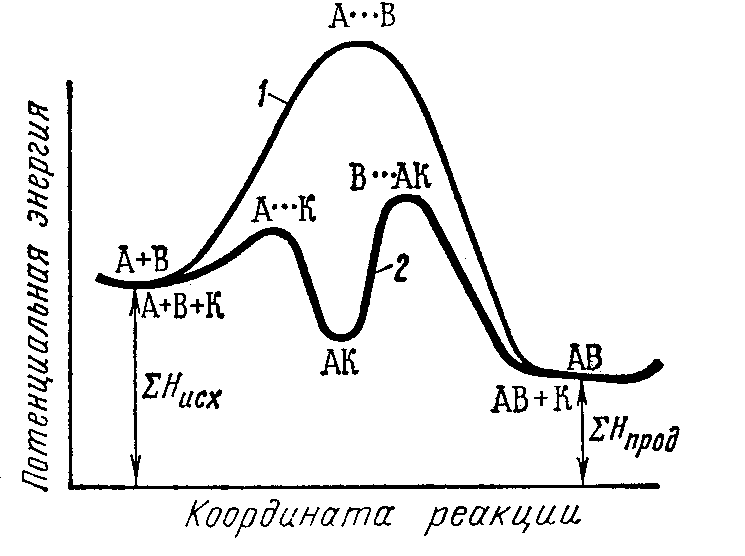
Рис. 46. Энергетическая схема хода реакции: 1 – без катализатора; 2 – в присутствии катализатора
В присутствии NO её скорость существенно возрастает, но сама реакция протекает в 2 этапа:
1) 2NO + O2 = 2NO2
2) NO2 + SO2 = SO3 + NO
В гетерогенном катализе важнейшую роль играет адсорбция.
Поверхность твёрдого катализатора является неоднородной. На ней выделяют так называемые активные центры. Они возникают в тех местах поверхности катализатора, где атомы или ионы слабее всего связаны с кристаллической решеткой, т.е. там, где силовое поле наименее насыщено: выступы или пики на поверхности, ребра граней кристаллов. Таких активных центров как правило мало. Они составляют всего лишь 0,1% от поверхности катализатора.
При этом реагирующие вещества адсорбируются на этих центрах. В результате чего увеличивается их концентрация на поверхности катализатора. А это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора (механизм этого воздействия является достаточно сложным и к настоящему времени детально не изучен) у адсорбированных молекул ослабляются связи между атомами и они становятся более реакционноспособными. Энергия активации реакции при этом существенно уменьшается.
После протекания реакции молекулы конечных продуктов десорбируются с активных центров катализатора и они могут присоединять к себе новые молекулы исходных веществ. Таким образом, в этом случае скорость реакции зависит ещё и от скоростей подвода к поверхности катализатора молекул исходных веществ и удаления молекул продуктов. В связи с этим для проведения гетерогенных процессов (как каталитических, так и некаталитических) в промышленности используют метод «кипящего слоя», при котором частички твёрдого вещества поддерживаются во взвешенном состоянии в жидкой или газовой фазе.
Активные центры обладают высокой чувствительностью к действию даже малых количеств каталитических ядов. Это объясняется тем, что их молекулы в первую очередь адсорбируются именно на активных центрах, блокируют их и выводят из участия в реакции.
Дата публикования: 2014-11-03; Прочитано: 4153 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
