 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.е. избирательность действия
|
|
Различают субстратную и групповую специфичность.
В случае субстратной специфичности ферменты проявляют каталитическую активность только по отношению к какому-нибудь одному исходному веществу (субстрату). Субстратная специфичность в большинстве случаев включает в себя и стереоспецифичность – проявление каталитической активности только по отношению к одному из стереоизомеров данного соединения. Так, большинство ферментов, катализирующих превращения аминокислот, активны по отношению к их L-изомерам и не активны по отношению к D-изомерам.
Ферменты с групповой специфичностью обеспечивают превращения разных субстратов, но имеющих определенные структурные фрагменты. Например, пищеварительные ферменты (пепсин, трипсин) расщепляют пептидные связи самых разных белков. Алкогольдегидрогеназа катализирует окисление метанола, этанола и других алифатических спиртов до альдегида.
Еще одно различие ферментов и обычных катализаторов заключается в том, что первые проявляют свою максимальную активность только в мягких условиях, характеризующихся небольшим интервалом температур и значений рН (рис. 47)

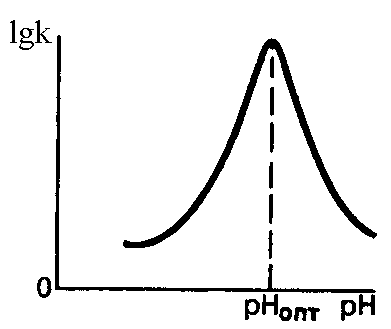
а б
Рис. 47. Зависимость логарифма константы скорости ферментативной реакции от: а – температуры, б – рН среды
Снижение активности фермента при температуре выше оптимальной связано с тепловой денатурацией белка, которая наступает при 50-60°С, а во многих случаях и при 40-42°С.
Снижение активности фермента при величинах рН, отличающихся от оптимального значения, объясняется изменением степени его ионизации, характера ион-ионных и других взаимодействий, обеспечивающих стабильность третичной структуры белка. Для большинства ферментов человеческого организма оптимальные значения рН совпадают с физиологическими (рН = 7,3-7,4).
Однако существуют ферменты, для нормального функционирования которых нужна сильно-кислая (рН = 1,5-2,5) (пепсин) или достаточно щелочная среда (рН = 9,5-9,9) (аргиназа).
Дата публикования: 2014-11-03; Прочитано: 897 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
