 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические методы основаны на непосредственном определении количества вещества или его концентрации в реакционном сосуде
|
|
Чаще всего для этих целей используют такие виды количественного анализа, как титриметрия и гравиметрия. Если реакция протекает медленно, то для контроля за расходованием реагентов через определённые промежутки времени из реакционной среды осуществляют отбор пробы. Затем определяют в них содержание нужного вещества. Например, титрованием щёлочью определяют количество кислоты в системе по мере протекания реакции
R1 – COOH + R2 – OH → R1 – COO – R2 + H2O
Если реакция протекает с большой скоростью, то для отбора пробы её останавливают с помощью резкого охлаждения, быстрого удаления катализатора, разбавления либо перевода одного из реагентов в нереакционное состояние.
Химические методы анализа отличает простота, доступность и хорошая точность.
В современной экспериментальной кинетике чаще всего используют физико-химические методы анализа. Они позволяют контролировать изменение концентрации вещества непосредственно в ходе протекания реакции, не останавливая её и не делая отбора пробы. Эти методы основаны на измерении какого-либо физического свойства системы, меняющегося во времени и зависящего от количественного содержания в ней определённого соединения; например: давления (если в реакции участвуют газы), электропроводности, показателя преломления, спектра поглощения реагента или продукта реакции в ультрафиолетовой, видимой либо инфракрасной областях. Широко используются спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР).
Применение спектральных методов основано на том, что поглощение электромагнитного излучения пропорционально количеству вещества или его концентрации в системе.
Обычно экспериментально изучают реакции в замкнутой системе (т.е. при постоянном объёме) и представляют результаты графически в виде так называемой кинетической кривой, выражающей зависимость концентрации реагента или продукта реакции от времени t. Аналитический вид этой зависимости называется уравнением кинетической кривой. В отличие от основного кинетического уравнения, уравнения кривых расходования реагирующих веществ (или накопления продуктов реакции) содержат в качестве параметров начальные концентрации компонентов (С0) в момент времени t=0.
Из этих уравнений выводят формулы для расчёта константы скорости реакции и времени полупревращения (t½) – промежутка времени, в течение которого расходуется половина взятого исходного вещества, т.е. его концентрация уменьшится в 2 раза и станет равной Со/2.
В реакциях нулевого порядка концентрация исходного вещества линейно уменьшается со временем (рис. 37)

Рис. 37. Изменение концентрации исходного вещества от времени в реакции нулевого порядка
Математически данная линейная зависимость запишется следующим образом
С = С0 – kt
где k – константа скорости, С0 – начальная молярная концентрация реагента, С – концентрация в момент времени t.
Из неё можно вывести формулу для расчёта константы скорости химической реакции нулевого порядка.
k = 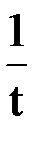 (C0 – C).
(C0 – C).
Константа скорости нулевого порядка измеряется в моль/л ∙ с (моль · л-1· с-1).
Время полупревращения для реакции нулевого порядка пропорционально концентрации исходного вещества
t½ = 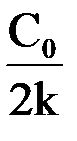
Для реакций первого порядка кинетическая кривая в координатах С, t носит экспоненциальный характер и выглядит следующим образом (рис. 38) Математически данная кривая описывается следующим уравнением
С = С0e-kt

Рис. 38. Изменение концентрации исходного вещества от времени в реакции первого порядка
На практике для реакций первого порядка кинетическую кривую чаще всего строят в координатах ℓnC, t. В этом случае наблюдается линейная зависимость ℓnС от времени (рис. 39)
ℓn С = ℓnС0 – kt
| ℓn С |
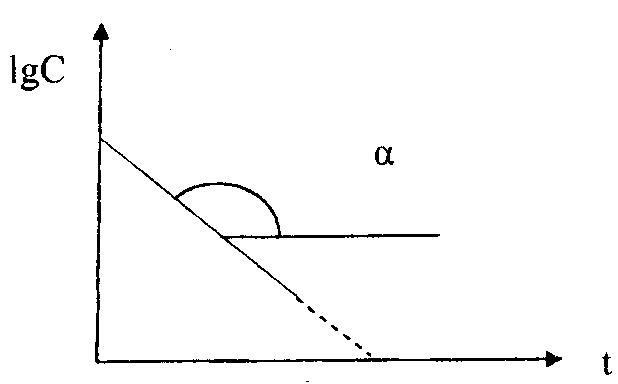
Рис. 39. Зависимость логарифма концентрации реагента от времени протекания для реакции первого порядка
Соответственно, величину константы скорости и время полупревращения можно рассчитать по следующим формулам
k =  ℓn
ℓn 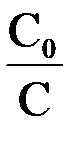 или k = 2,303
или k = 2,303 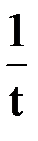 ℓg
ℓg 
(при переходе от десятичного логарифма к натуральному).
t½ = 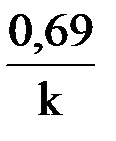
Константа скорости реакции первого порядка имеет размерность t –1, т.е. 1/с и не зависит от единиц измерения концентрации. Она показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул реагента в системе. Таким образом, в реакциях первого порядка за одинаковые промежутки времени расходуются одинаковы доли взятого количества исходного вещества.
Второй отличительной особенностью реакций первого порядка является то, что t½ для них не зависит от начальной концентрации реагента, а определяется только константой скорости.
Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С, t (рис. 40). Математическое уравнение этой зависимости запишется следующим образом
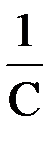 =
= 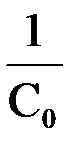 + kt
+ kt
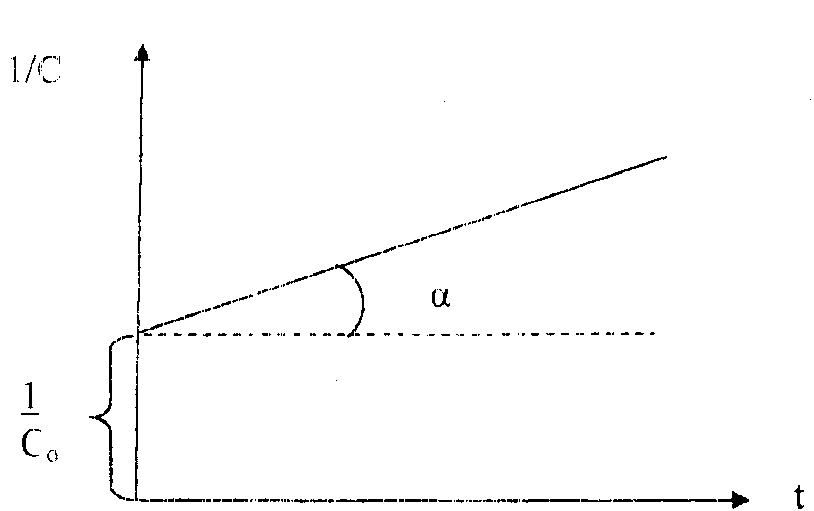
Рис. 40. Зависимость величины обратной концентрации реагента от времени для реакции второго порядка
Дата публикования: 2014-11-03; Прочитано: 911 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
