 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Порядок и молекулярность простых химических реакций
|
|
В главном кинетическом уравнении химической реакции
аA + bВ + … →
u = k ·  ·
·  · …
· …
а, b, … – это постоянные, не зависящие от концентрации вещества числа, называемые показателями порядка реакции, соответственно, по реагентам А, В, …. Их сумма (a + b +…= n) называется суммарным или общим порядком реакции.
Порядок реакции по каждому из реагентов (или частный порядок реакции) совпадает с его стехиометрическим коэффициентом в химическом уравнении только для простых реакций, протекающих в одну стадию. При этом в элементарном акте такой реакции (соударении) принимают участие и претерпевают изменения не более трёх частиц: молекул, ионов либо радикалов. В соответствии с этим различают мономолекулярные, бимолекулярные и тримолекулярные реакции (последние встречаются крайне редко). Тетра- и более молекулярные простые реакции неизвестны, т.к. вероятность одновременного соударения 4-х и более частиц крайне мала. Таким образом, молекулярность реакции может выражаться только целым числом.
В элементарном акте мономолекулярной реакции превращению подвергается одна частица, а в качестве продукта могут образоваться не только одна, но и две другие частицы (в некоторых случаях три и больше). Схематически это можно представить следующим образом:
А → В; А → 2В; А → В + С; А → В + С + D.
Кинетическое уравнение таких реакций выглядит так:
u = k · CA.
Это уравнение реакции первого порядка (причём частный и общий порядок в нём совпадают и равны 1).
Мономолекулярные реакции, как правило, являются эндотермическими, и для их протекания необходима активация, т.е. переход частицы А в возбуждённое состояние А*, энергия которого достаточна для преодоления потенциального барьера на пути реакции.
Мономолекулярными чаще всего являются реакции разложения или изомеризации некоторых веществ, например:
1) диссоциация молекул брома на 2 радикала
Br2  2Br;
2Br;
2) термическое разложение диметилового эфира
СН3 – О – СН3 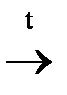 CH4 + CO + H2;
CH4 + CO + H2;
3) изомеризация роданистого аммония в тиомочевину
NH4CNS ® (NH2)2CS
В элементарном акте бимолекулярной реакции превращению подвергаются две (одинаковые либо разные) частицы, с образованием одной и более частиц продуктов:
2А → С; 2А → С + В; А + В → С + D;
А + В → С; А + В → С + D + F
Кинетическое уравнение таких реакций в зависимости от вида исходных частиц выглядит следующим образом:
1) u = k ·  (если обе исходные частицы одинаковые);
(если обе исходные частицы одинаковые);
2) u = k · CA · CB (если частицы реагентов разные по своей природе).
В обоих случаях общий порядок реакции равен 2. Причём для реакций первого типа он совпадает с частным порядком реакции по реагенту А. Для реакций второго типа частный порядок реакции по каждому из реагентов равен 1.
Бимолекулярные реакции являются наиболее распространёнными, протекают, как правило, в газовой или жидкой фазе и могут принадлежать к самому разному типу, например:
H2 + I2 = 2HI
CO + Cl2 = COCl2
реакции соединения
2NOI = 2NO + I2
реакция разложения
СН3 – СOO – С2H5 + NaOH → CH3 – COONa + C2H5OH
реакция обмена.
Дата публикования: 2014-11-03; Прочитано: 865 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
