 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Воспламенение и горение частицы топлива
|
|
Горение частицы пылевидного топлива. Примем следующую модель процесса: реагирование протекает на поверхности частицы топлива сферической формы; частица в газовой среде движется вместе с ней с одинаковой скоростью; горение выделяющихся летучих и догорание продуктов неполного сгорания происходит в объеме газовой среды; конвективный перенос теплоты из системы отсутствует, а лучистый теплообмен моделируется взаимодействием реагирующей смеси с облучателем, температура которого принимается постоянной; теплообмен частицы с газовой средой происходит путем конвекции и диффузионной теплопроводности [3].
Как известно, при очень тонком размоле углей зола топлива отделяется и поэтому в мелких частицах не содержится. С учетом того, что в процессе приготовления угольной пыли топливо подсушивается, в расчетах принято, что в процесс горения вступают топливные частицы, состоящие только из горючей массы.
В начальный момент времени газовая среда имеет температуру, значительно превышающую температуру частицы. Частица топлива воспринимает теплоту газовой среды конвекцией и от горящего факела – радиацией и нагревается. При этом из него возгоняются летучие. Выделяющиеся летучие могут реагировать в газовой фазе, а твердая коксовая масса – в гетерогенном режиме.
В расчетах принята наиболее общая схема реагирования: углерод реагирует с кислородом газовой фазы с образованием СО и СО2, получающийся диоксид углерода может реагировать с твердой фазой, образуя СО. Оксид углерода, получаемый как в первичном, так и во вторичном процессе реагирования, вступает в химическое соединение с кислородом в газовой фазе. Принимается, что гетерогенные реакции и реакции, протекающие в окружающем частицу газовом объеме, идут по следующим итоговым уравнениям:
- окисление углерода до СО
2С + О2 = 2СО + QСО; (82)
- окисление углерода до СО2
С + О2 = СО2 + 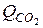 ; (83)
; (83)
- восстановление диоксида углерода
СО2 + С = 2СО - 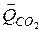 ; (84)
; (84)
- горение оксида углерода
2СО + О2 = 2СО + Q12. (85)
Теплота химического реагирования, протекающего на поверхности частицы, передается конвекцией и диффузионной теплопроводностью окружающей газовой среде и частично расходуется на дальнейшей нагрев самой частицы. Температура частицы возрастает, причем это возрастание происходит тем более интенсивно, чем интенсивнее протекает химическое реагирование и чем меньше теплоотдача в газовую среду. В ходе реагирования диаметр частицы уменьшается, изменяются температура частицы, температура и состав газовой среды.
Горение единичной капли жидкого топлива и горение жидкого топлива в факеле подробно рассмотрено в [1].
Дата публикования: 2014-11-04; Прочитано: 789 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
