 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическое равновесие. Как уже указывалось, химические реакции идут в обе стороны с одновременным образованием конечных продуктов и исходных веществ
|
|
Как уже указывалось, химические реакции идут в обе стороны с одновременным образованием конечных продуктов и исходных веществ. Если процесс химического реагирования длится достаточно долго, то между исходными и конечными продуктами реакции устанавливается динамическое равновесие. Так, тело, в разных местах которого поддерживается разная, но постоянная во времени температура, находится в стационарном состоянии. Если тело изолировать от внешней среды, то постепенно температура его во всем объеме выравнивается и наступает равновесное состояние. Таким образом, стационарное состояние определяется внешними условиями, а равновесие – внутренними причинами. Условия равновесия описываются с помощью функций состояния. В соответствии со вторым законом термодинамики, для функции состояния энтропии можно записать условие равновесия идеального обратимого процесса
ds – dQ/T = dQ’/T, (58)
где dQ — теплота из внешней среды; dQ' — теплота реагирования внутри системы. При V, s = const условие химического равновесия имеет вид
 . (59)
. (59)
Внутренняя энергия U в этом случае называется термодинамическим потенциалом, сопряженным с параметрами V и s. Если использовать вместо V и s другие термодинамические пары, то можно получить при равновесии следующее равенство:
 , (60)
, (60)
где Н=U+pV — энтальпия; F=U—Ts — изохорно-изотермический потенциал (энергия Гельмгольца); G = Н—Ts — изобарно-изотермический потенциал (энергия Гиббса). Отсюда следует, что условие равновесия одинаково для всех типов процессов (изотермических, изобарических и др.).
В зависимости от условий (температуры, давления) равновесие смещается в сторону исходных веществ или в сторону продуктов распада. Известно правило, называемое принципом Ле-Шателье-Брауна. В соответствии с этим принципом при изменении условий, в которых происходит реакция, равновесие смещается так, чтобы противодействовать изменению этих условий. Например, при горении прямая реакция идет с выделением теплоты, а обратная — с поглощением; в этом случае при повышении температуры в системе равновесие смещается в сторону исходных веществ, тепловыделение уменьшается, при понижении температуры равновесие смещается в сторону продуктов реакции. При не очень высоких температурах эти смещения незначительны.
Давление воздействует на положение равновесия, когда реакция протекает с изменением объема газов. В этом случае при повышении давления равновесие смещается в сторону уменьшения объема, а при понижении давления — в сторону увеличения объема. Так, в реакции
2Н2 + О2 = 2Н2О
с ростом давления равновесная полнота реагирования водорода с кислородом повышается, при уменьшении давления увеличивается равновесный распад водяного пара.
Принцип Ле-Шателье-Брауна показывает качественный характер смещения равновесия, но не позволяет провести количественные расчеты равновесного состава. Расчет равновесного состава является очень трудной задачей. Здесь мы укажем только общие положения такого расчета и поясним некоторые зависимости, необходимые для понимания процессов горения.
Пусть идеальная газовая смесь имеет температуру Т0,при которой известен ее состав, и объем V; в процессе реагирования смесь не обменивается массой с окружающей средой; температура смеси изменяется от Т0 до Т, при этом устанавливается новый равновесный состав. Перепишем уравнение (55) в следующем виде:
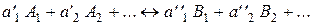 . (61)
. (61)
С приближением к условию (60), т. е. при стремлении термодинамической системы к равновесию, для реакции (61) можно записать
 , (62)
, (62)
где 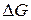 – изменение изобарно-изотермического потенциала в реакции при стандартном давлении (1,01·104 Па) и температуре Т;
– изменение изобарно-изотермического потенциала в реакции при стандартном давлении (1,01·104 Па) и температуре Т;  — изменение энтальпии, равное теплоте реакции Qp при постоянном давлении;
— изменение энтальпии, равное теплоте реакции Qp при постоянном давлении;  — изменение энтропии в реакции;
— изменение энтропии в реакции;  и
и 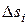 — теплота образования и энтропия исходных веществ и продуктов реакции при стандартном давлении и температуре Т; хА, хА, …;
— теплота образования и энтропия исходных веществ и продуктов реакции при стандартном давлении и температуре Т; хА, хА, …;  … — относительные молярные концентрации исходных веществ и продуктов реакции (см. (57), (54)).
… — относительные молярные концентрации исходных веществ и продуктов реакции (см. (57), (54)).
Кх называется константой равновесия по относительным молярным концентрациям. Она зависит от давления и температуры. Выражение (62) есть закон действующих масс (термодинамический): при равновесии связь между массами участвующих в прямой и обратной реакциях веществ определяется константой равновесия.
Запишем выражение (62) в виде
 . (63)
. (63)
Кроме константы равновесия Кх, используют константы равновесия по парциальным давлениям Кр и молярным концентрациям Кс:
 , (64)
, (64)
 . (65)
. (65)
3.2.3.1.3. Кинетический закон действующих масс
Впредыдущих разделах были рассмотрены химические реакции с точки зрения термодинамики. При этом считалось, что равновесные концентрации в реакциях горения устанавливались мгновенно, и время из рассмотрения исключалось. Для многих практических задач такой подход правомерен, однако имеются задачи, когда необходим анализ химических процессов в их временном развитии. Скорости и механизмы механических процессов, законы их протекания во времени изучает химическая кинетика.
Равновесное состояние химический реакции вовсе не означает, что реакция прекратилась. В действительности реакция протекает непрерывно, но с одинаковой скоростью в обоих направлениях. Общее представление о скорости реакции было рассмотрено в ранее. Скорость зависит от концентрации реагентов и температуры. При постоянной температуре скорости прямой w" и обратной w" реакций пропорциональны произведениям концентраций реагентов, возведенных в целочисленные степени (равные стехиометрическим коэффициентам):
 ;
;  . (66)
. (66)
Коэффициенты пропорциональности k’ и k’’, зависящие от температуры и химической природы реагирующих веществ (ноне от концентраций), называют константами скоростей. Константа скорости — это скорость реакции, которая была бы при условии, что концентрации всех реагентов равны единице, во все время реагирования.
Скорость реакции пропорциональна числу столкновений молекул реагирующих веществ в единицу времени, а число столкновений в свою очередь пропорционально произведению концентрации; этим элементарно обосновывается кинетический закон действующих масс, который можно записать в виде

 . (67)
. (67)
По мере расходования в процессе реагирования исходных реагентов скорость прямой реакции будет уменьшаться, а скорость обратной — увеличиваться, и наступит момент, когда w’ = w’’ и w = 0. Мы опять пришли к понятию равновесного состояния, но теперь с позиции кинетики: равновесие — это равенство скоростей прямой и обратной реакций. Из (67) при условии равновесия следует
 , (68)
, (68)
что соответствует определению константы равновесия по концентрациям (см. (65)).
Дата публикования: 2014-11-04; Прочитано: 885 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
