 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Закон Аррениуса
|
|
Константа скорости элементарной реакции при постоянных концентрациях реагирующих веществ зависит от температуры но закону Аррениуса
 , (69)
, (69)
где E – энергия активации, Дж/моль;  — частотный фактор, учитывающий общее столкновение молекул, размерность
— частотный фактор, учитывающий общее столкновение молекул, размерность  совпадает с размерностью k.
совпадает с размерностью k.
Чтобы произошел один элементарный акт химической реакции, необходимо столкновение молекул и их взаимодействие. Число столкновений очень велико (численно оно пропорционально Т 1/2), но не всякое столкновение приводит к реакции.
Пусть в процессе некоторой реакции один атом от молекулы А переходит к молекуле В, в результате чего образуются новые вещества С и D. Энергия ядра атома при химических реакциях не меняется, изменяется лишь энергия взаимодействия атома со всеми другими атомами. Условно зависимость энергии перехода атома от молекулы А к молекуле В можно изобразить в виде кривой (рис. 4). Зависимость энергии атома от координаты реакции х имеет два локальных минимума (и максимум между ними). Ордината (·) А – энергия атома в молекуле А. Состояние в (·) А устойчиво по отношению к бесконечно малым внешним воздействиям, иначе существование вещества А было бы невозможно. Ордината (·) В — энергия атома в молекуле В. Состояние в (·) В также устойчиво в малом.
Чтобы реакция произошла, т. е. чтобы атом смог перейти or молекулы А к молекуле В, нужно при столкновении молекул передать атому энергию, большую чем U0—UA. Атом должен преодолеть этот потенциальный барьер. Энергия U0—UA, проходящая через один моль вещества, и есть энергия активации:
 ,
,
где 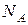 – количество молекул А, находящихся в одном моле.
– количество молекул А, находящихся в одном моле.
Экспоненциальный множитель — E/(RT) в законе Аррениуса (69)называется активационным множителем. Он указывает долю столкновений от общего их числа, при которых может произойти реакция.
После завершения реакции энергия атома становится равной  . Величина
. Величина  — теплота реакции одного моля вещества. На рис. 4.
— теплота реакции одного моля вещества. На рис. 4.

Рис. 4. Энергия перехода при превращениях молекул
переход от А к В — экзотермическая реакция:  >0. В случае обратной реакции атом преодолевает потенциальный барьер U0—UA более высокий, чем в прямой реакции; обратная реакция эндотермическая, теплота поглощается, причем в том же количестве, в котором она выделилась в прямой реакции. Теплота реакции не имеет прямого отношения к численному значению потенциального барьера, т. е. нет связи между теплотой реакции и энергией активации.
>0. В случае обратной реакции атом преодолевает потенциальный барьер U0—UA более высокий, чем в прямой реакции; обратная реакция эндотермическая, теплота поглощается, причем в том же количестве, в котором она выделилась в прямой реакции. Теплота реакции не имеет прямого отношения к численному значению потенциального барьера, т. е. нет связи между теплотой реакции и энергией активации.
Дата публикования: 2014-11-04; Прочитано: 2727 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
