 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Параметры смесей и химические реакции
|
|
Газообразное топливо, пары жидкого топлива, воздух, продукты сгорания топлива состоят из различных химических компонентов, образующих газовую смесь. Состояние однокомпонентного газа определяется двумя термодинамическими параметрами: давлением и температурой, многокомпонентного – химическим составом, давлением и температурой. В процессе горения одни вещества исчезают и возникают другие. Термодинамика реагирующих в процессе горения веществ учитывает взаимные превращения веществ, энергии, теплоты и работы.
Состав сложной многокомпонентной смеси определяется концентрацией компонентов. Концентрацию i –го вещества в смеси определяют как число молекул Ni в единице объема V. В этом случае говорят о молекулярной концентрации
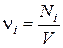 . (42)
. (42)
Молярная концентрация определяет число молей ni в единице объема
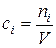 . (43)
. (43)
Плотность i –го вещества
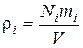 , (44)
, (44)
где mi – масса молекулы i – го вещества,
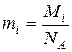 , (45)
, (45)
где Mi –молекулярная масса i -го вещества; NA = 6,02*1023 моль-1 – число Авагадро. Число молекул i -го вещества можно определить из выражения Ni = NAni.
Используя вышеприведенные выражения, легко установить связь между концентрациями
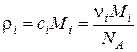 . (46)
. (46)
Используют также относительные концентрации:
- относительная молярная концентрация определяется отношением
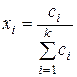 , (47)
, (47)
где  – число молей в смеси всех веществ, занимающих объем V, отнесенное к этому объему, т. е.
– число молей в смеси всех веществ, занимающих объем V, отнесенное к этому объему, т. е.  = С, тогда
= С, тогда  = 1;
= 1;
- относительная массовая концентрация
 (
(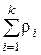 =
= 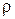 ;
; 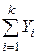 =1). (48)
=1). (48)
Молекулярная масса смеси
 . (49)
. (49)
Отсюда
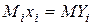 и
и  . (50)
. (50)
Приведенные соотношения справедливы как для газов, так для твердых и жидких однородных смесей, в которых компоненты распределены равномерно по всему объему.
В теории горения принимается, что все компоненты газовой смеси являются идеальными газами, т. е. в них отсутствует взаимное притяжение между молекулами, а объем молекул пренебрежимо мал по сравнению с объемом, занимаемым газом. Уравнение состояния i- го газа устанавливает связь между его парциальным давлением рi, концентрацией  , температурой Т:
, температурой Т:
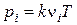 , (51)
, (51)
где k =1,38·10-23Дж/К – постоянная Больцмана. Известно, что k=R/NA, ранее было показано, что 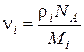 , тогда
, тогда
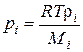 , (52)
, (52)
где R =8,31 Дж/(моль·К) – универсальная газовая постоянная.
Закон Дальтона, справедливый для идеальных газов, имеет вид
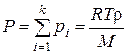 , (53)
, (53)
т. е. давление смеси газов равно сумме парциальных давлений его компонентов.
Используя закон Авогадро (при одинаковых давлении и температуре одинаковые количества вещества различных идеальных газов занимают один и тот же объем), можно определить относительную молярную концентрацию i -го вещества из выражения
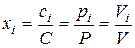 , (54)
, (54)
где Vi – парциальный объем i -го вещества.
Уравнение химических реакций в общем виде можно описать следующим выражением:
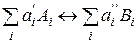 (i =1,2…, k), (55)
(i =1,2…, k), (55)
где i - номер реагирующего вещества;  – стехиометрический коэффициент i -го реагента в прямой реакции (т. е. реакции, идущей слева направо);
– стехиометрический коэффициент i -го реагента в прямой реакции (т. е. реакции, идущей слева направо);  – то же для обратной реакции; Аi, Вi – химические символы i -х реагентов. Стехиометрические коэффициенты – это коэффициенты, определяющие количественные соотношения между реагирующими веществами.
– то же для обратной реакции; Аi, Вi – химические символы i -х реагентов. Стехиометрические коэффициенты – это коэффициенты, определяющие количественные соотношения между реагирующими веществами.
Слева и справа от стрелок записаны все реагирующие вещества, исходные и конечные, так что  = 0 для конечных продуктов
= 0 для конечных продуктов  = 0 для исходных реагирующих веществ прямой реакции.
= 0 для исходных реагирующих веществ прямой реакции.
Скорость химической реакции. Пусть за время  в ходе химической реакции число молекул каждого реагирующего вещества из общего их количества i =1, 2, …, k изменится на значение
в ходе химической реакции число молекул каждого реагирующего вещества из общего их количества i =1, 2, …, k изменится на значение 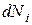 . При отсутствии обмена массы реагирующих веществ с окружающей средой
. При отсутствии обмена массы реагирующих веществ с окружающей средой
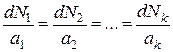 , (56)
, (56)
т. е. изменение количеств реагирующих веществ пропорционально их стехиометрическим коэффициентам. Это одно из определений известного в химии закона кратных отношений. В ходе химических реакций происходит превращение одних веществ в другие, молекулы исходных веществ в процессе химического реагирования исчезают, однако количество каждого типа атомов сохраняется неизменным. Равенство (56) выражает сам факт сохранения атомов при химических превращениях. Иначе закон сохранения атомов можно записать в форме
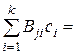
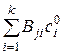 , (57)
, (57)
где Вji – число атомов j -го типа в i -м веществе; сi 0 – молярная концентрация вещества до реагирования. Изменение числа молей любого вещества в процессе реагирования называется скоростью реакций w =(dc i/ d 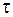 )/ ai, где
)/ ai, где 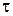 – время.
– время.
Дата публикования: 2014-11-04; Прочитано: 1095 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
