 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методы выделения и очистки белков
|
|
Последовательность операций по выделению белков обычно сводится к измельчению биологического материала, экстрагированию белков (т.е. переводу их в растворенное состояние) и, наконец, выделению исследуемого белка из смеси других белков, т.е. очистке и получению индивидуального белка. Все операции проводят при температуре, близкой к 0°С и не применяют сильных кислот и оснований, чтобы избежатьденатурации.
Исходный биологический материал измельчают при помощи ножевых или пестиковых гомогенизаторов, часто используют валковые или шаровыемельницы. Кроме того, применяется метод попеременного замораживания и оттаивания ткани, в основе разрушающего действия котороголежат разрывы клеточной оболочки, вызванные кристалликами льда.Для разрушения тканей используют также ультразвук, пресс-методы и метод "азотной бомбы", который заключается в насыщении клетоказотом под высоким давлением, а затем резким сбрасыванием давления - выделяющийся газообразный азот как бы "взрывает" клетки.
Измельченную ткань заливают экстрагентом, в качестве, которогоиспользуют 8-10% растворы солей, буферные смеси, органические растворители, а также неионные детергенты - вещества, нарушающие гидрофобные взаимодействия между белками и липидами, между белковымимолекулами. Однако ими пользуются осторожно, чтобы не нарушить третичную (четвертичную) структуру белков. Из органических соединенийиспользуют водные растворы глицерина и слабые растворы сахарозы. Таккак растворению и стабилизации белков способствуют кислые и слабощелочные среды, то в качестве буферных смесей используютфосфатные, цитратные, боратные буферные смеси. Нерастворимые частиткани осаждают центрифугированием. В надосадочной жидкости содержатся растворимые белки.
Главнаятрудность выделения индивидуального белка в его отделении отостальных белков, так как все белки обладают сходными свойствами и ихразделение основано на небольших различиях в свойствах разных белков.
Рассмотрим ряд методов выделения белков.
1. Избирательная денатурация. Многие белки денатурируются и выпадают в осадок при нагревании раствора до 50-70 °С или при подкислении до рН ≈ 5. Если выделяемый белок выдерживает эти условия, то часть посторонних белков можно удалить из раствора таким способом.
2. Высаливание представляет собой процесс осаждения белков из раствора при добавлении различных солей. Чаще всего используют зависимость растворимости белков от концентрации сульфата аммония. Если в раствор добавить небольшое количество (NH4)2SO4, (например, 10г на 100мл раствора), то наименее растворимые белки выпадут в осадок. Осадок отделяют центрифугированием, а к надосадочной жидкости добавляют еще 10 г (NH4)2S04 и получают второй осадок. Продолжая эту процедуру, получают ряд фракций: в одной из них содержание искомого белка больше, чем в других.
3. Методы ионно-обменной хроматографии и электрофореза основаны на различиях в количестве и природе ионогенных групп аминокислотных радикалов. Для хроматографии белков применяют ионообменники на основе целлюлозы или других гидрофильных полимеров.
Электрофорез применяют в различных вариантах. Наиболее простой из них - электрофорез на бумаге. Полоску фильтровальной бумаги пропитывают буферным раствором и включают ее в электрическую цепь с постоянным током. Процедуру проводят в герметически закрытой камере. Белки из электрофореграмме обнаруживают, обрабатывая полоску красителем, связывающимся с белками и образующим цветные соединения. После окончательного разделения белков на фракции, в зависимости от заряда белковой молекулы, отдельные белки вымывают (предварительно разрезав полоску на части) подходящим растворителем и осаждают. Для получения больших количеств очищенного белка вместо полоски бумаги в этом методе используют толстый блок какого-либо инертного материала - крахмала, целлюлозного порошка или полимеры, образующие гели - агар, полиакриламид.
4. Методы гель-фильтрации и ультрацентрифугирования основаны на различиях белков по молекулярной массе.
Молекулярная масса белков достигает десятки и сотни тысяч атомных единиц массы (а.е.м., или Да). Обычные методы определения молекулярной массы - криоскопия и эбулиоскопия - для белков неприменимы. Для определения молекулярных масс белков разработаны специфические методы. Наиболее распространенный из них - метод ультрацентрифугирования, разработанный шведским ученым Сведбергом. Он основан на измерении скорости седиментации веществ. Во вращающемся роторе ультрацентрифуги центробежное ускорение достигает 100000 - 500000 g (g - ускорение свободного падения). На поверхность буферного раствора, налитого в кювету ультрацентрифуги, наносят тонкий слой раствора белка и кювету помещают в ротор. При вращении ротора более плотные, чем растворитель, молекулы белка перемещаются в направлении от оси вращения. Положение белковой зоны регистрируют специальной оптической системой по показателю преломления, который больше в зоне белка, чем в буферном растворе. На основании результатов центрифигурирования вычисляют коэффициент седиментации

где
х - расстояние от оси вращения до белковой зоны, см;
t - время седиментации, с;
dx/dt –скорость седиментации, см/с;
ω- угловая скорость вращения ротора, рад/с.
За единицу коэффициента седиментации условно принята величина 10-13 с, называемая сведбергом и обозначаемая "S".
Молекулярная масса белка пропорциональна его коэффициенту седиментации, коэффициенту диффузии и плотности:
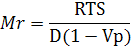
Где
R - универсальная газовая постоянная (8.314 Дж/град моль);
Т - абсолютная температура опыта;
S - коэффициент седиментации, с;
О - коэффициент диффузии, см2/с;
V - удельный парциональный объем молекулы белка, т.е. величина, обратная плотности молекулы, см3/г;
р - плотность растворителя при данной температуре, г/см3.
Более просто молекулярную массу белка можно определить методом гель-фильтрации, или молекулярного просеивания. Метод основан на применении специальных полимерных веществ (например, сефадекс), набухшие зерна которых имеют поры определенного размера. Небольшие молекулы легко проходят в эти поры, а диффузия крупных молекул затруднена. Это явление и лежит в основе разделения веществ методом гель-фильтрации. Принципиальная схема метода изображена на рисунке приведенном ниже, белковый раствор вместе с буфером перемещаются вдоль колонки между гранулами сефадекса. Белки проходят медленнее, чем буферный раствор, причем тем медленнее, чем меньше молекулярная масса белка, так как их молекулы легче диффундируют внутрь гранул сефадекса.
В результате в колонке образуются отдельные зоны белков: чем ниже расположена зона, тем больше молекулярная масса белка. Белковые фракции, различающиеся молекулярной массой, собирают в отдельные пробирки и идентифицируют хроматографически. Между объемом вымывания (объем буфферного раствора, затраченный на вымывание из колонки данной фракции - V, мл) и логарифмом молекулярной массы (IgM) - линейная зависимость (см. рис.9,б). Предварительно колонку калибруют, пропуская через нее растворы стадартных белков с известной молекулярной массой.

Очистка белков
Белки, всегда содержат некоторое количество низкомолекулярных примесей, особенно ионов солей. Для полного освобождения от этих примесей белки подвергают дальнейшей очистке путем диализа, электродиализа, кристаллизации и перекристаллизации.
Метод диализа состоит в длительном (сутки и больше) пропускании воды через сосуд, в который погружен диализационный мешочек с раствором белка. Его делают из материалов, хорошо проницаемых для маленьких молекул и ионов, но не пропускающих большие молекулы белка. К таким материалам относят целлофан, коллодиевую пленку и др. Таким образом, происходит вымывание низкомолекулярных примесей из раствора белка через диализационный материал, внутри остается белок. Затем диализ продолжают еще 1-3 суток дистиллированной водой. Но даже после диализа на поверхности белковых молекул могут оставаться частично ионы. Потому далее полученный раствор белка подвергают электродиализу: против мембран диализационной камеры (мешочка) помещают электроды, на которые подают напряжение, в результате чего в омывающую мембраны воду уходят остатки ионов.
Дата публикования: 2015-11-01; Прочитано: 3150 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
