 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
|
|
Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления.
Окисление – это отдача электронов элементом, т. е. повышение его степени окисления.
Восстановителем называется вещество, в состав которого входит элемент, повышающий степень окисления. К типичным восстановителям относятся простые вещества, имеющие малую электроотрицательность (металлы, водород и др.), катионы и анионы, атомы которых находятся в низких или низших степеней окисления. Низшая степень окисления для неметаллов равна номеру группы минус 8.
Восстановление – принятие электронов элементом или понижение его степени окисления.
Окислителем называется вещество, в состав которого входит элемент, понижающий степень окисления. Типичными окислителями являются простые вещества, атомы которых имеют высокую электроотрицательность (галогены, кислород), катионы и анионы, атомы которых имеют высокую или высшую степень окисления. Высшая степень окисления атома равна номеру группы, в которой он находится.
Многие вещества, в зависимости от партнера и условий проведения реакции могут быть как восстановителями, так и окислителями. В этом случае говорят об окислительно-восстановительной двойственности.
Уравнения окислительно-восстановительных реакций представляет иногда сложную задачу, поэтому для облегчения уравнивания предложено несколько методов. Наиболее часто используются метод полуреакций, электронного баланса и по изменению степени окисления.
Рассмотрим правила определения степеней окисления в соединениях.
1. Степень окисления элемента в простых соединениях (состоят из одного типа химических элементов: Н2, Р4, Fe) равна нулю.
2. Водород в большинстве соединений имеет степень окисления +1, но в соединениях с металлами (гидридах: NaH, CaH2) она равна –1.
3. Кислород имеет степень окисления –2, за исключением пероксидов (Н2О2 и др.), где степень окисления равна –1.
4. Фтор во всех соединениях имеет степень окисления –1.
5. Металлы в соединениях имеют положительную степень окисления. Кроме того:
первая группа, главная подгруппа (щелочные металлы) +1;
вторая группа вся, кроме ртути +2;
алюминий +3.
6. Алгебраическая сумма степеней окисления в нейтральной молекуле равна нулю, а в сложном ионе – заряду иона.
Степень окисления указывается над символом атома со знаком плюс или минус впереди.
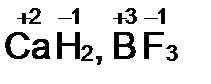 .
.
Пример.
Определить степени окисления в соединениях Са(ClO2)2 и NH4NO3.
Решение.
В Са(ClO2) 2 известны степени окисления кальция (II группа) +2 и кислорода –2. Обозначив степень окисления хлора за «х», составляем уравнение и находим неизвестную степень окисления.
2 + 2.(х + 2(–2)) = 0; 2 + 2х – 8 = 0; х = +3. Хлор в этом соединении имеет степень окисления +3.
NH4NO3 – нитрат аммония является солью азотной кислоты HNO3, в которой азот имеет степень окисления +5 (1 + х + 3(–2) = 0); х=+5. В NH4NO3 х + 4.(+1) + 5 + 3.(–2) = 0; х = –3.
В этом соединении азот имеет две степени окисления +5 в нитрат ионе и –3 в катионе аммония.
Рассмотрим составление уравнения окислительно-восстановительной реакции по методу электронного баланса на примере реакции
Fe2O3 + Br2 + KOH = K2FeO4 + KBr + H2O
1. Расставим степени окисления у элементов в данном уравнении, согласно правилам, изложенным выше.
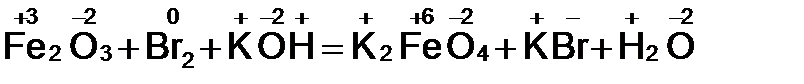
2. Видим, что у железа степень окисления повышается (это полуреакция окисления), а у брома – понижается (полуреакция восстановления). Запишем эти две полуреакции с указанием электронов, отдаваемых восстановителем и принимаемых окислителем.
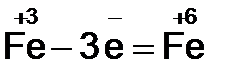
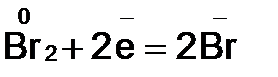
Необходимо, чтобы число отданных и принятых электронов было равно, поэтому первую полуреакцию умножим на 2, а вторую на 3.
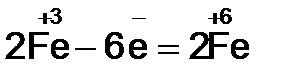
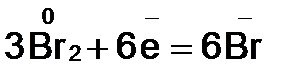
Расставим коэффициенты в основном уравнении. 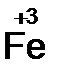 должно быть 2 моль. В Fe2O3 уже есть 2 моль железа, поэтому коэффициент перед этой молекулой равен единице. Br2 должно быть 3 моль;
должно быть 2 моль. В Fe2O3 уже есть 2 моль железа, поэтому коэффициент перед этой молекулой равен единице. Br2 должно быть 3 моль; 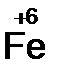 – 2 моль, а KBr – 6 моль.
– 2 моль, а KBr – 6 моль.
Fe2O3 + 3Br2 + KOH = 2K2FeO4 + 6KBr + H2O
Метод электронного баланса позволяет расставить коэффициенты только перед окислителем и восстановителем, остальные расставляются методом подбора. Сначала уравнивается калий, потом водород, а кислород в последнюю очередь.
В правой части 10 калия, ставим 10 перед КОН. Стало 10 моль водорода в левой части, ставим 5 перед водой. Количество кислорода при правильной расстановке оказывается уравнено самостоятельно.
Fe2O3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 5H2O
Fe2O3 в этой реакции будет восстановителем, а Br2 – окислителем.
Так как окислитель и восстановитель находятся в разных соединениях, то тип ОВР называется межмолекулярный
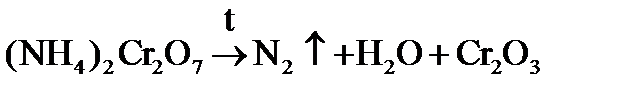 Яркий опыт протекает при разложении оранжевого дихромата аммония, в результате которого образуются газообразный азот, вода и темно-зеленый оксид хрома(III). Это реакция «вулкан».
Яркий опыт протекает при разложении оранжевого дихромата аммония, в результате которого образуются газообразный азот, вода и темно-зеленый оксид хрома(III). Это реакция «вулкан».



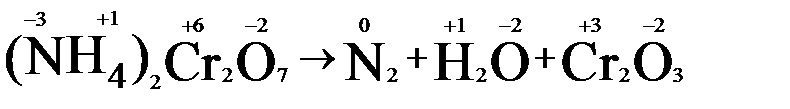 1. Расставим степени окисления у элементов в данном уравнении, согласно правилам, изложенным выше.
1. Расставим степени окисления у элементов в данном уравнении, согласно правилам, изложенным выше.
 2. Видим, что у азота степень окисления повышается (это полуреакция окисления), а у хрома – понижается (полуреакция восстановления). Запишем эти две полуреакции с указанием электронов, отдаваемых восстановителем и принимаемых окислителем.
2. Видим, что у азота степень окисления повышается (это полуреакция окисления), а у хрома – понижается (полуреакция восстановления). Запишем эти две полуреакции с указанием электронов, отдаваемых восстановителем и принимаемых окислителем.
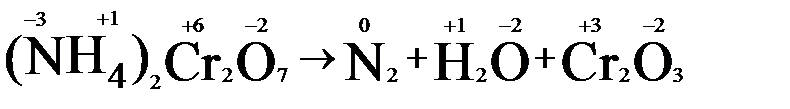 Расставим коэффициенты перед окислителем и восстановителем в уравнении.
Расставим коэффициенты перед окислителем и восстановителем в уравнении.
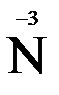 должно быть 2 моль. В дихромате аммония уже есть 2 моль азота.
должно быть 2 моль. В дихромате аммония уже есть 2 моль азота.
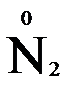
должно быть 2 моль. В молекуле азота уже есть 2 моль азота.
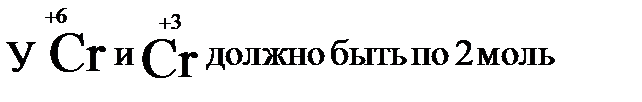
В дихромате аммония и в оксиде хрома(III) уже есть по 2 моль хрома. Значит перед дихроматом аммония, азотом и оксидом хрома(III) должны стоять единицы, которые обычно не ставятся.
 Уравниваем водород, для этого перед водой ставим 4. Кислород сам уравнялся.
Уравниваем водород, для этого перед водой ставим 4. Кислород сам уравнялся.
В этом уравнении и элемент окислитель, и элемент восстановитель находятся в одном соединении, но это разные элементы. Такой тип ОВР называется внутримолекулярный.
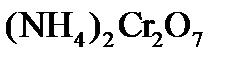 А окислителем и восстановителем будет являться одно и то же соединение – дихромат аммония
А окислителем и восстановителем будет являться одно и то же соединение – дихромат аммония
Дата публикования: 2015-10-09; Прочитано: 2199 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
