 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
|
|
Электролитами называют вещества, которые в растворах проводят электрический ток. К электролитам относятся кислоты, основания и растворимые соли. При растворении в воде они распадаются на ионы движение которых обеспечивает электропроводность растворов этих веществ. Этим вопросом много занимался Аррениус. Он пришел к выводу, что диссоциация молекул растворенных электролитов на ионы происходит не под действием тока, как считали до него, а уже в процессе растворения, независимо от того пропускают через раствор электрический ток или нет.

Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита пользуются степенью электролитической диссоциации a.

Основные положения теории электролитической диссоциации были разработана Гунде Сван Аррениусом (1887) и сводятся к следующему.
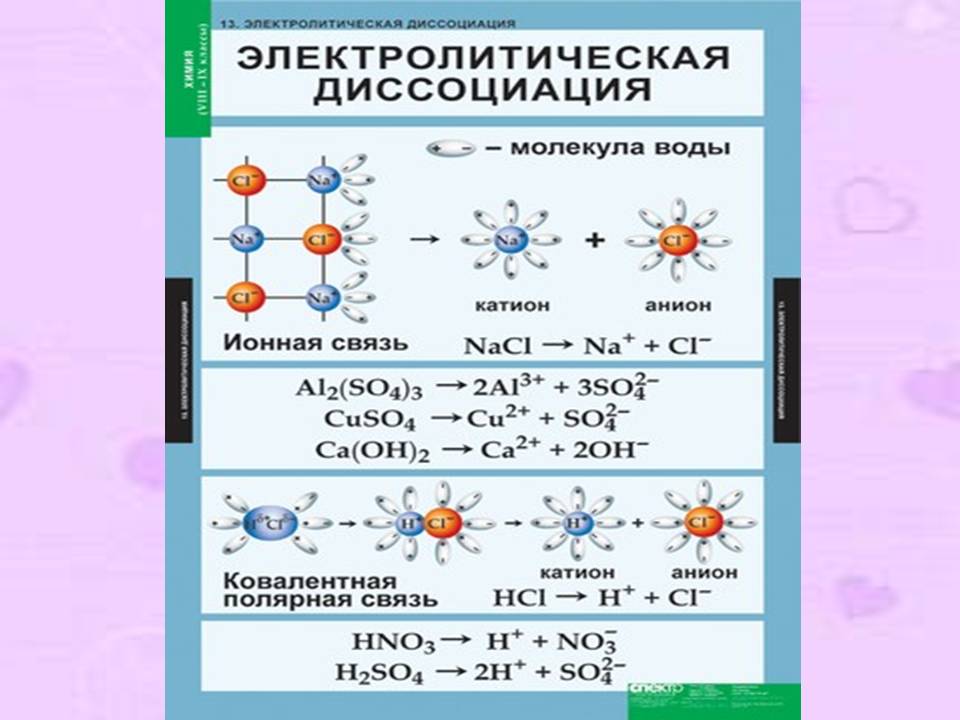
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – частицы с положительным (катионы) и отрицательным (анионы) зарядом. Ионы могут быть простыми (Na+, S2- и т.д.), сложными (NH4+, SO42- и т.д.) или комплексными ([Fe(CN)6]4-, [Cu(NH3)4]2+ и т.д.). «Ион» в переводе с греческого означает «странствующий»: в растворе ионы беспорядочно передвигаются в различных направлениях.
2. Под действием электрического тока движение ионов становится направленным: катионы движутся к катоду, а анионы к аноду. По этому признаку все соединения делятся на электролиты и неэлектролиты.
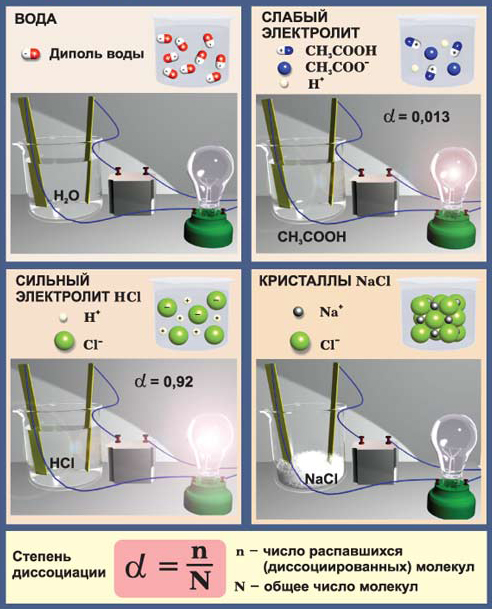
Чистая вода очень слабый электролит – лампочка не горит; Уксусная кислота слабый электролит – лампочка горит слабо; соляная кислота (HCl) сильный электролит – лампочка горит ярко; кристаллический NaCl не содержит ионы – лампочка не горит. Ионы у хлорида натрия появляются только в растворе или в расплаве.
3. Диссоциация – обратимый процесс, поэтому в уравнениях ставится знак обратимости.
NaCl D Na+ + Cl-; H2SO4 D 2H+ + SO42-
Легче всего диссоциируют вещества с ионной связью, состоящие из ионов. Полярные молекулы воды (диполи) притягиваются к поверхностным ионам вещества; происходит ослабление химической связи между ионами, которое зависит от диэлектрической проницаемости растворителя (у воды оно очень велико 81). Достаточно теплового движения молекул, чтобы вещество распалось на гидратированные ионы.
Расплавы ионных соединений тоже являются сильными электролитами. Высокая температура расплавов способствует их диссоциации на ионы.
Для веществ с ковалентно-полярными связями сначала происходит поляризация связи под действием диполей воды; связь превращается в ионную и происходит диссоциация на гидратированные ионы.
Доказано, что все ионы находятся в растворе в гидратированном состоянии, что препятствует их обратное соединение – ассоциацию. Правильнее написать диссоциацию так:
NaCl + (n+m)H2O D Na+nH2O + Cl-mH2O,
Однако, в связи с тем, что неопределенный состав гидратов для решения практических задач не имеет значения, схемы диссоциации записываются без участия воды.
Существует классификация электролитов по величине степени электролитической диссоциации, которую ввел Аррениус.
Электролиты, для которых в децимолярном (С=0,1 моль/л) растворе при 25оС α>0,3, называются сильными. Эта классификация является условной, т.к. степень диссоциации зависит от концентрации раствора, применяемого растворителя. Более удобным показателем силы электролита является константа диссоциации, которая не зависит от концентрации.
Дата публикования: 2015-10-09; Прочитано: 3447 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
