 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Закон действующих масс для химического равновесия
|
|
При постоянстве давления и температуры отношение концентраций продуктов реакции и исходных веществ – число постоянное, и не зависит от конкретных значений концентраций.
Для реакции аА + вВ = сС + dD математическим выражением закона действующих масс для химического равновесия является равенство.
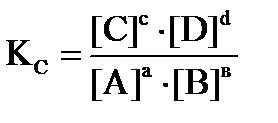
Константа равновесия определяет глубину протекания процесса в момент достижения равновесия. Чем больше Кс, тем полнее произошло взаимодействие между реагентами. Большинство химических реакций является гетерогенными, опыт показывает, что конденсированные фазы (жидкие и твердые) не оказывают влияние на константу равновесия. Изменение их массы, связанное с расходом или образованием веществ в исследуемой реакции не влечет за собой изменение состава и не нарушает равновесия, поэтому эти вещества не входят в константу равновесия.
Дата публикования: 2015-10-09; Прочитано: 970 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
