 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Закономерности в спектре атома водорода
|
|
Опыт показывает, что спектры невзаимодействующих атомов, как это имеет место для разреженных газов, состоят из отдельных линий, сгруппированных в серии.
На рис. 5.3 показаны линии серии спектра атома водорода, расположенные в видимой области. Длина волны, соответствующая линиям в этой серии, называемой серией Бальмера, выражается формулой

где, n = 3, 4, 5,...;  - постоянная Ридберга.
- постоянная Ридберга.

Рис. 5.3
Линия, соответствующая n = 3, является наиболее яркой и называется головной, а значению n = ∞ соответствует линия, называемая границей серии.
В других областях спектра (ультрафиолетовой, инфракрасной) также были обнаружены серии линий. Все они могут быть представлены обобщенной формулой Бальмера - Ридберга

где m - целое число, постоянное для каждой серии.
При m = 1; n = 2,3,4,... - серия Лаймана. Наблюдается в ультрафиолетовой области.
При m = 2; n = 3,4,5,... - серия Бальмера - в видимой области.
При m = 3; n = 4,5,6,... - серия Пашена - в инфракрасной (ИК) области.
При m = 4; n = 5,6,7,... - серия Брэкета - тоже в ИК области и т. д.
Дискретность в структуре атомных спектров указывает на наличие дискретности в строении самих атомов. Для энергии квантов излучения атомов водорода можно записать следующую формулу
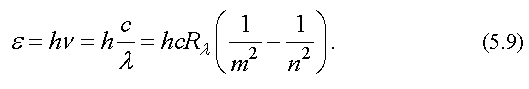
При записи этого выражения использованы формулы (5.1), (3.21) и (5.8). Формула (5.9) получена на основе анализа экспериментальных данных.
Дата публикования: 2015-09-17; Прочитано: 989 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
