 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Завдання науково-дослідного характеру
|
|
Перший закон термодинаміки не дозволяє визначити напрям перебігу термодинамічних процесів, тобто в його формулюванні немає заборони для процесу передачі теплоти від холодного тіла до гарячого. Насправді так процес йти не може. Другий закон термодинаміки говорить: неможливий процес, єдиним результатом якого була б передача енергії у вигляді тепла, від холодного тіла до гарячого.
Фізична характеристика системи, зміна якої під час переходу системи з одного стану в інший не залежить від виду відповідного цьому переходу термодинамічного процесу, а повністю визначається значеннями параметрів початкового й кінцевого станів, називається функцією стану. Найважливішими функціями стану системи є внутрішня енергія U, ентропія S. Під час переходу системи з стану 1 в стан 2 зміна внутрішньої енергії, наприклад: 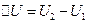 не залежить від виду процесу. Дія кругового процесу (в результаті якого система повертається в початковий стан):
не залежить від виду процесу. Дія кругового процесу (в результаті якого система повертається в початковий стан):  .
.
Ентропією називається функція 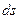 стану системи, що визначається співвідношенням:
стану системи, що визначається співвідношенням:
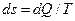 , (4)
, (4)
 . (5)
. (5)
Формули (4), (5) дають змогу підрахувати лише зміну ентропії. За законом зміни ентропії системи в оборотному процесі можливо зробити висновок про напрям теплообміну (під час нагріванні тіла ентропія зростає 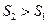 під час охолодженні зменшується
під час охолодженні зменшується 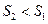 . Під час рівноважних адіабатичних процесів
. Під час рівноважних адіабатичних процесів 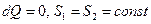 – ентропія не зменшується. Під час інших процесах - ізохоричному, ізобаричному, ізотермічному - ентропія змінюється. Зокрема під час рівноважного ізотермічного процесу
– ентропія не зменшується. Під час інших процесах - ізохоричному, ізобаричному, ізотермічному - ентропія змінюється. Зокрема під час рівноважного ізотермічного процесу 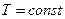 , зміна ентропії дорівнює:
, зміна ентропії дорівнює:
 . (6)
. (6)
У неізольованих термодинамічних системах ентропія завжди збільшується:
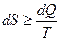 ;
; 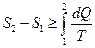 .
.
Знак рівності належить до оборотніх процесів (тобто до таких, які можливо провести в зворотному напрямку через ті самі стани), а знак нерівності - до необоротних. Усі реальні процеси необоротні, тому ентропія завжди зростає.
Розглянемо зміну ентропії під час випаровування води в процесі кипіння. Процес кипіння відбувається за постійної температури - температури кипіння і є ізотермічним. Зміна ентропії під час цього визначається із співвіднонення:
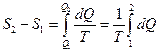 . (7)
. (7)
Кількість теплоти, яку потрібно затратити, щоб нагріти воду від кімнатної температури 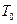 до температури кипіння
до температури кипіння 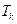 :
:
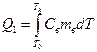 , (8)
, (8)
де 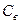 і
і 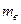 - теплоємність і маса води.
- теплоємність і маса води.
Кількість теплоти, необхідна на перетворення в пару маси води 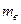 (дорівнює кількості теплоти, що виділиться під час конденсації такої ж маси пари) за температури кипіння:
(дорівнює кількості теплоти, що виділиться під час конденсації такої ж маси пари) за температури кипіння:
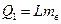 ,
,
де L - питома теплота випаровування (конденсації).
Приріст ентропії під час випаровування можна розрахувати за формулами (6) і (7)
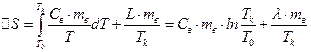 . (9)
. (9)
Хід роботи:
1. Визначивши 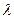 в попередній роботі, за формулою (9) визначити зміну ентропії під час випаровування в процесі кипіння для маси
в попередній роботі, за формулою (9) визначити зміну ентропії під час випаровування в процесі кипіння для маси 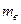 , заданої викладачем.
, заданої викладачем.
Дата публикования: 2015-09-17; Прочитано: 302 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
