 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теоретичні відомості. Під час не дуже низьких температур для твердих тіл виконується закон Дюлонга і Пті, згідно з яким молярна теплоємність усіх хімічно простих тіл приблизно
|
|
Під час не дуже низьких температур для твердих тіл виконується закон Дюлонга і Пті, згідно з яким молярна теплоємність усіх хімічно простих тіл приблизно дорівнює 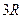 (
( - універсальна газова стала):
- універсальна газова стала):
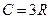 . (1)
. (1)
Це співвідношення можна одержати теоретично, виходячи з наступних міркувань. Атоми твердого тіла за температур, відмінних від абсолютного нуля, здійснюють коливання відносно положень рівноваги в просторі. Під час незначного зміщення атома з положення рівноваги в деякому напрямку 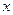 на нього діє квазіпружна сила:
на нього діє квазіпружна сила: 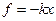 Потенціальна енергія зміщеного атома
Потенціальна енергія зміщеного атома 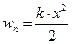 , а кінетична
, а кінетична 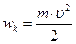 . Повна енергія:
. Повна енергія:
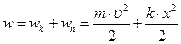 .
.
Під час коливань атома відбувається безперервне перетворення кінетичної енергії в потенціальну й навпаки. За даної температури Т середня кінетична енергія великої кількості атомів дорівнює середній потенціальній енергії їх коливного руху й за теоремою про рівномірний розподіл енергії за степенями вільності 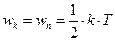 .
.
В ізотропному тілі коливання частинок у всіх напрямках рівноймовірні. Тому 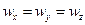 , а середня повна енергія одного з великої кількості атомів:
, а середня повна енергія одного з великої кількості атомів: 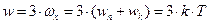 .
.
Енергія кіломоля речовини дорівнює добуткові середньої енергії коливного руху одного атома на кількість атомів у кіломолі:
 (2)
(2)
Енергія кіломоля речовини виражається через універсальну газову сталу  .
.
Молярною теплоємністю речовини 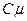 називається фізична величина, яка вимірюється кількістю теплоти, необхідною для нагрівання 1 кмоля речовини на 1 кельвін.
називається фізична величина, яка вимірюється кількістю теплоти, необхідною для нагрівання 1 кмоля речовини на 1 кельвін.
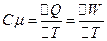 . (3)
. (3)
Підставляючи у (1) вираз для 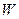 з (2), одержимо закон Дюлонга і Пті:
з (2), одержимо закон Дюлонга і Пті:
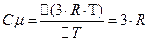 . (4)
. (4)
У цій роботі перевіряється справедливість закону Дюлонга і Пті для хімічно простих твердих тіл.
Для цього експериментально знаходяться їх питомі теплоємності, а тоді вираховуються їх атомні теплоємності.
Питомою теплоємністю речовини 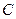 називається фізична величина, що вимірюється кількістю теплоти, необхідною для нагрівання одиниці маси речовини на 1 градус. Молярна теплоємність
називається фізична величина, що вимірюється кількістю теплоти, необхідною для нагрівання одиниці маси речовини на 1 градус. Молярна теплоємність 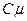 пов’язана з питомою теплоємністю
пов’язана з питомою теплоємністю 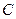 співвідношенням:
співвідношенням:
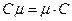 . (5)
. (5)
де 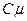 - маса кіломоля.
- маса кіломоля.
Для визначення питомої теплоємності твердого тіла вимірюють його масу, нагрівають у спеціальному нагрівнику, опускать його в калориметр із водою і відзначають температуру, яка встановиться в калориметрі у стані рівноваги під час вимірювання температури тіла, води в калориметрі і калориметра. Кількість теплоти, відданої тілом під час охолодження:
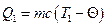 . (6)
. (6)
де  - маса, досліджуваного тіла;
- маса, досліджуваного тіла; 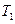 - температура тіла після нагрівання;
- температура тіла після нагрівання; 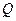 - температура, що встановилася в калориметрі. Ця кількість теплоти йде на нагрівання води, калориметра й термометра за умови, що втрати тепла в навколишній простір дуже малі. Кількість теплоти, що йде на нагрівання води й калориметра:
- температура, що встановилася в калориметрі. Ця кількість теплоти йде на нагрівання води, калориметра й термометра за умови, що втрати тепла в навколишній простір дуже малі. Кількість теплоти, що йде на нагрівання води й калориметра:
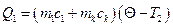 . (7)
. (7)
де 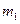 - маса вода в калориметрі,
- маса вода в калориметрі, 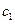 - питома теплоємність води;
- питома теплоємність води; 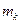 - маса калориметра,
- маса калориметра, 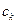 - питома теплоємність калориметра (алюміній),
- питома теплоємність калориметра (алюміній), 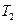 - температура води в калориметрі до знаходження в ньому нагрітого тіла.
- температура води в калориметрі до знаходження в ньому нагрітого тіла.
Виходячи із закону збереження енергії: 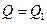 .
.
Хід роботи:
1. Визначити масу досліджуваного тіла  , води в калориметрі
, води в калориметрі 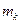 .
.
2. Увімкнути пароутворювач і нагріти за допомогою пари в нагрівнику досліджуване тіло. Температура нагріву 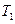 визначається за термометром, встановленм у кришці нагрівника.
визначається за термометром, встановленм у кришці нагрівника.
3. Визначити початкову температуру води в калориметрі 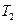 , відкривши заслонку нагрівника, швидко опустимо нагріте тіло в калориметр з водою.
, відкривши заслонку нагрівника, швидко опустимо нагріте тіло в калориметр з водою.
4. Визначити рівноважну температуру  (це буде максимальна температура, до якої нагріється вода в калориметрі після опускання в неї нагрітого тіла).
(це буде максимальна температура, до якої нагріється вода в калориметрі після опускання в неї нагрітого тіла).
5. За формулою (6) визначити питому теплоємність, а за формулою (2) - молярну теплоємність.
6. За формулою (1) розрахувати теоретичне значення 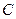 .
.
7. Дослід повторити два рази.
Контрольні питання
1. Чим пояснити одержану різницю між теоретичним та експериментальним значенням молярної теплоємності?
2. Вивести співвідношення Дюлонга і Пті.
3. Якою повинна бути молярна теплоємкість хімічно складних тіл, наприклад солі 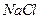 ?
?
Звітна таблиця
| № п/п | 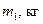
| 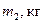
| 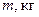
| 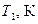
| 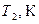
| 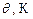
| 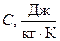
| 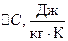
| 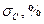
|
| Сер. |
Лабораторна робота №18
Дата публикования: 2015-09-17; Прочитано: 615 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
