 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическая связь в твердых телах
|
|
Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними. Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так, для NaCl tпл. = 801 °C, а для NaNO3 tпл = 306,5 °C.
Пример 1. Каким типом гибридизации АО бериллия описывается образование молекулы хлорида бериллия? Какова конфигурация этой молекулы?
Решение:
Возбужденный атом бериллия имеет конфигурацию 2s12p1. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. В молекуле BeCl2 должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны – это объясняет метод гибридизации. В данном случае имеет место sp- гибридизация
При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.
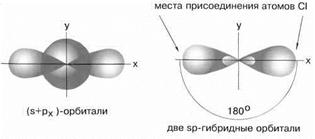
Экспериментальные данные показывают, что все галогениды Be, а также Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину.
Пример 2. Определите тип гибридизации орбиталей центрального атома в молекуле BF3. Какова конфигурация этой молекулы?
Решение:
Возбуждённый атом бора имеет конфигурацию 2s12p2.
В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу.

sp2-гибридизация
Пример 3. Каким типом гибридизации АО азота описывается образование молекулы аммиака?
Решение:
В результате гибридизации 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о , соответствующие тетраэдру.

sp3- гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Пример 4. Объяснить с позиций метода МО возможность существования молекулярного иона Не2+
Решение:
В молекулярном ионе Не2 + имеется три электрона. На связывающей орбитали размещены два электрона, а на разрыхляющей — один. Следовательно, порядок связи равен 0,5, и такой ион должен быть энергетически устойчивым.
Пример 5. Определите энергию связи кислород-водород в молекуле Н2О если энергия связи Н–Н и О–О соответственно равны 435,9 и 498,7 кДж/моль, а при сгорании 2 моль водорода выделяется 483,68 кДж теплоты.
Решение:
Процесс образования молекулы воды можно представить следующим образом: рвутся связи водород-водород и кислород-кислород а образовавшиеся атомы соединяются в молекулы Н2О каждая из которых содержит две связи кислород-водород:
4Н(г) = 2Н2(г) – 435,9∙2 кДж
2О(г) = О2(г) – 498,7 кДж
2Н2(г) + О2(г) = 2Н2О(г) – 483,68 кДж
----------------------------------------------------
4Н(г) + 2О(г) = 2Н2О(г) –– 1854,18 кДж
В двух молекулах Н2О четыре связи кислород–водород; средняя энергия связи кислород – водород равна: –1854,18 / 4 = – 463,54 кДж/моль
Дата публикования: 2014-10-16; Прочитано: 2365 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
