 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Р-элементов VI и VII групп
|
|
 Хотя водородные связи приблизительно в 20 раз менее прочные, чем ковалентные, но именно благодаря ним вода в обычных условиях является жидкостью или льдом, (а не газом). Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар, но прочность водородной связи такова, что даже при 100оС доля разорванных водородных связей составляет лишь 20% к их общему количеству. Ассоциаты полностью разрушаются лишь при переходе воды в пар.
Хотя водородные связи приблизительно в 20 раз менее прочные, чем ковалентные, но именно благодаря ним вода в обычных условиях является жидкостью или льдом, (а не газом). Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар, но прочность водородной связи такова, что даже при 100оС доля разорванных водородных связей составляет лишь 20% к их общему количеству. Ассоциаты полностью разрушаются лишь при переходе воды в пар.
Прочностью ассоциатов объясняется аномально высокая теплоёмкость воды, поскольку при нагревании воды много энергии расходуется на разрыв водородных связей. При понижении температуры водородные связи восстанавливаются, освобождая энергию.
При температурах выше 0оС (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру. В жидкой воде молекулы связаны между собой в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты — все крупнее. Наконец, образуется лед, который имеет именно такую упорядоченную структуру.
На рис 27 показан фрагмент структуры льда. В кристалле льда молекулы воды ориентируются таким образом, чтобы образовать максимальное число водородных связей. Каждый атом кислорода в этой структуре тетраэдрически связан с четырьмя другими атомами; между ними располагаются атомы водорода. Два из них соединены с данным атомом кислорода полярной ковалентной связью, два других — водородной связью,т.е. входят в состав других молекул Н2О. Таким образом, получается ажурная структура, далёкая от плотной упаковки. Вследствие этого лёд имеет небольшую плотность и значительную рыхлость. Любая молекула соединена тремя связями с молекулами своего слоя и лишь одной связью с соседним слоем. Поэтому слои легко перемещаются относительно друг друга. Каждый слой молекул состоит из шестичленных колец, которые, располагаясь друг над другом, образуют пустоты. Объем этих пустот больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивает свою плотность.
При таянии льда рвётся лишь часть водородных связей, поэтому в жидкой воде сохраняются фрагменты структуры льда, между которыми находятся молекулы воды, не связанныве водородными связями. Эти молекулы заполняют пустоты, в результате плотность жидкой воды при ОоС выше, чем у льда, а объём воды жидкой по сравнению с объёмом тающего льда не возрастает как у других веществ, а уменьшается. При повышении температуры от ОоС до 4оС доля разорванных водородных связей и, следовательно, свободной воды, заполняющей пустоты, увеличивается; поэтому возрастает и плотность воды, которая достигает максимального значения при 4оС. При дальнейшем повышении температуры термическое расширение воды преобладает над уменьшением объёма обусловленного более высокой упаковкой и плотность воды уменьшается.

Рис.27 Окружение молекулы воды в структуре льда
Растворимость и другие свойства водородных соединений
Водородная связь весьма распространена и играет важную роль в процессах растворения, кристаллизации, электролитической диссоциации и других физико-химических процессах.
В водных растворах фтороводород находится в виде устойчивых димеров H2F2. При растворении в воде происходит процесс:
H2F2 + H2O = H3O+ + HF2– . В растворе содержатся также комплексные ионы H2F3–,H3F4– (в общем виде HnF–n+1).
Вследствие наличия водородной связи фтороводородная кислота (в отличие от её аналогов(HCl,HBr и HI) не является сильной кислотой.
Константа кислотности HF в водном растворе Ка = 6,7 ∙ 10–4
Если вещество способно образовать водородные связи с молекулами растворителя, то оно обладает хорошей растворимостью. По этой причине неограниченно растворяются в воде: хлороводород, аммиак, фтористый водород, этиловый спирт и многие другие вещества.
Отсутствием влияния водородной связи объясняются случаи, когда полярные соединения не растворимы в полярном растворителе — воде. Так, полярный C2H5I хорошо растворяет неполярный нафталин, но сам не растворяется в воде.
Способностью к образованию водородных связей объясняется растворимость в воде некоторых белков. На поверхности белков находятся гидрофильные группы (–OH,–COOH,–NH2 и др.), которые посредством водородных связей присоединяют молекулы воды. Таким образом, каждая белковая молекула гидратирована. При разрыве водородных связей гидратная оболочка разрушается, и молекулы объединяются в более крупные агрегаты— белок выпадает в осадок. Это происходит, например, под действием солей щелочных металлов, спиртов, ацетона.
Внутримолекулярные водородные связи
Наряду с межмолекулярной водородной связью соединяющей отдельные молекулы существует и внутримолекулярная водородная связь, соединяющая атом водорода с каким-либо атомом той же молекулы. Особенно такая связь характерна для многих органических веществ (аминокислот, белков,амидов,многоатомных спиртов и др.).
Внутримолекулярная связь возникает, например, в молекулах салициловой кислоты и нитрофенола:
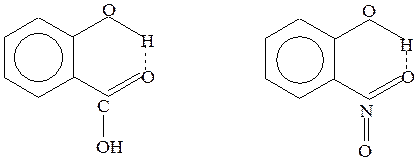 Салициловая кислота Нитрофенол
Салициловая кислота Нитрофенол
Рис.28 Водородные связи в салициловой кислоте и нитрофеноле
Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеII(см.рис.29).
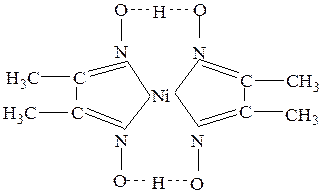
Рис.29 Бис(диметилглиоксимато) никель II
Водородные связи в значительной степени определяют устойчивость конформации белков. Внутримолекулярные водородные связи между группами >C=O и >N−H полипептидной цепи поддерживают
α–спиральную структуру белка. Межмолекулярные водородные связи двух полипептидных цепей определеяют образование слоистых белковых структур. Молекулы ДНК состоят из трёх частей: фосфатных групп, углеводных остатков(дезоксирибоза) и пуриновых и пиримидиновых оснований(аденин, цитозин, гуанин, тимин). Остов молекулы составляют чередующиеся углеводные и фосфатные остатки. С каждым углеводным о соединено пуриновое или пиримидиновое основание.Двойная спираль образуется за счёт того, что водородные связи между основаниями удерживают вместе две отдельные спирали.Основания ориентированы примерно перпендикулярно спирали.Каждое основание может образовать прочную связь только с одним из четырёх оснований, встречающихся в ДНК.Эта специфичность оснований составляет основу генетического кода.
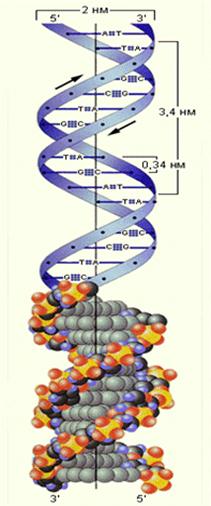
Рис. 30 Строение молекулы ДНК
Дата публикования: 2014-10-16; Прочитано: 1759 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
