 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Квантовые числа
|
|
Для полного описания состояния каждого электрона в атоме в квантово-волновой механике используется система четырех параметров га, l, mi, ms, называемых квантовыми числами (табл. 1.1). Квантовые числа - величины безразмерные.
Главное квантовое число n. Главное квантовое число - это положительное целое число, 1, 2, 3, 4,...,  , которое характеризует в основном энергию электрона, т. е. энергетический уровень. При n= 1 электрон находится на самом низком энергетическом уровне. По мере возрастания n энергия уровня увеличивается. Помимо энергии главное квантовое число также характеризует удаленность данного электрона от ядра (r). Чем больше величина n, тем дальше находится электрон от ядра и тем больше его энергия:
, которое характеризует в основном энергию электрона, т. е. энергетический уровень. При n= 1 электрон находится на самом низком энергетическом уровне. По мере возрастания n энергия уровня увеличивается. Помимо энергии главное квантовое число также характеризует удаленность данного электрона от ядра (r). Чем больше величина n, тем дальше находится электрон от ядра и тем больше его энергия:

Кроме того, значение главного квантового числа также указывает на число энергетических подуровней, соответствующих данному уровню, - оно равно значению n. Так, в первом энергетическом уровне n = 1) имеется один подуровень, во втором (n = 2) - два, в третьем (n = 3) - три, в четвертом (n = 4) - четыре подуровня и т. д.
 |
Таким образом, главное квантовое число n определяет энергетический уровень электрона в атоме. Хотя оно может принимать любые целочисленные значения от 1 до да, но для электронов в невозбужденных атомах известных в настоящее время элементов оно изменяется от 1 до 7, что соответствует числу периодов в современной периодической системе Менделеева.
Орбитальное квантовое число l. Число l характеризует величину орбитального момента количества движения электрона, другими словами, уточняет энергетическое состояние электронов в пределах данного уровня, т. е. энергию подуровня. Наряду с этим орбитальное квантовое число характеризует форму атомных орбиталей электрона, соответствующих данному подуровню.
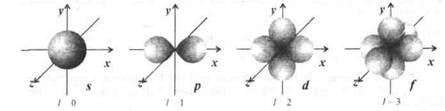
Для электронов, находящихся на энергетическом уровне с главным квантовым числом n, орбитальное квантовое число l может принимать значения 0, 1, 2, 3,..., (n - 1). При l = 0 имеем энергетический s-подуровень, которому соответствует сферическая форма атомной орбитали, называемой s-орбиталью. При l = 1 имеем энергетический р-подуровень, содержащий атомные орбитали двух лепестковой формы (объемная восьмерка), которые называются р-орбиталями. Если l = 2, то имеем энергетический d-подуровень, где форма атомных орбиталей (d-орбиталей) - че тырехлепестковая. В случае l = 3 имеем энергетический f-подуровень, на котором форма атомных орбиталей (f-орбиталей) -шестилепестковая (рис. 1.1).
Для многоэлектронных атомов, вследствие межэлектронных взаимодействий, в пределах одного энергетического уровня величины энергии его подуровней различны, причем  <
<  Следовательно, энергия электрона в многоэлектронном атоме зависит не только от n, но и от l и возрастает с увеличением суммы n + l (правило В. М. Клечковского). Энергия электронов, которые находятся на одном уровне и на одном и том же подуровне, т. е. на атомныхорбиталях одного типа, одинакова.
Следовательно, энергия электрона в многоэлектронном атоме зависит не только от n, но и от l и возрастает с увеличением суммы n + l (правило В. М. Клечковского). Энергия электронов, которые находятся на одном уровне и на одном и том же подуровне, т. е. на атомныхорбиталях одного типа, одинакова.
Магнитное (азимутальное) квантовое число ml. Величина ml характеризует направление орбитального момента количества движения электрона и связанного с ним магнитного момента, другими словами, она определяет ориентацию атомных орбита-лей в магнитном поле атома, а также число атомных орбиталей на энергетическом подуровне. Магнитное квантовое число принимает целочисленные значения от -l до +l, включая и нуль, т. е. всего 21 + 1 значений, которым отвечает число атомных оробиталей в данном подуровне. Так, любой s-подуровень, где l= 0, ml = 0, содержит одну s-орбиталь; р-подуровень, где l =1, ml= -1, 0, +1 - три р-орбитали, ориентированные по координатным осям х, у, z (рис. 1.1); d-подуровень, где l =2, ml = -2, -1, 0, +1, +2 - пять d-орбиталей, симметрично ориентированных в пространстве; f-подуровень, где l = 3, ml= -3, -2, -1, 0, +1, +2, +3 -семь f-орбиталей.
Таким образом, с помощью трех квантовых чисел n, l и т полностью описывается состояние электрона относительно ядра, т. е. характеризуется атомная орбиталь, на которой он находится.
|
Рис. 1.1. Пространственная форма s-, р-, d- и f -атомных орбиталей
Спиновое квантовое число тs. Число ms характеризует собственный момент количества движения электрона, получивший название спин, и принимает два значения: +1/2 и -1/2. Поскольку спин может иметь два противоположных направления, его часто обозначают  или
или  . Электроны, находящиеся на одной орбитали и обладающие противоположно направленными спинами
. Электроны, находящиеся на одной орбитали и обладающие противоположно направленными спинами  , называются спаренными, а одиночный электрон на орбитали называется неспаренным.
, называются спаренными, а одиночный электрон на орбитали называется неспаренным.
Характеристики состояния электрона в атоме, которые определяются четырьмя квантовыми числами, представлены в табл. 1.1.
Дата публикования: 2014-10-16; Прочитано: 1977 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
