 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Применение первого начала термодинамики к изопроцессам
|
|
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
– Изохорный процесс (V = const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис.11.5), где процесс 1-2есть изохорное нагревание, а 1-3— изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
δА = pdV = 0.
Из первого начала термодинамикидля изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии: δQ=dU.
Согласно формуле (11.12),
dUm=CVdT.
Тогда для произвольной массы газа получим
dQ=dU= 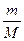 CVdT. (11.18)
CVdT. (11.18)
 – Изобарный процесс (р= const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа при увеличении объема от V 1 до V 2равна
– Изобарный процесс (р= const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа при увеличении объема от V 1 до V 2равна
Рис.11.5 Рис.11.6
A=  (11.19 )
(11.19 )
и определяется площадью заштрихованного прямоугольника (рис.11.7).
Если использовать уравнение Клапейрона — Менделеева для выбранных нами двух состояний, то
pV 1 =νRT 1, pV 2 =νRT 2,
откуда
V 2 –V 1= ν  (T 2 –T 1).
(T 2 –T 1).
Тогда выражение для работы изобарного расширения примет вид
A=νR (Т 2 -Т 1). (11.20)
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если (Т 2 –Т 1) = 1 К, то для 1 моль газа R=A,т. е. R численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой т количества теплоты
dQ= 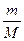 CpdT,
CpdT,
его внутренняя энергия возрастает на величину
dU= 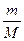 CVdT.
CVdT.
При этом газ совершит работу, определяемую выражением (11.20).
– Изотермический процесс (Т= const). Как уже указывалось, изотермический процесс описывается законом Бойля—Мариотта:
pV= const.
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу. Найдем работу изотермического расширения газа:
 .
.
Так как при T =const внутренняя энергия идеального газа не изменяется:
dU= 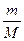 CVdT= 0,
CVdT= 0,
то из первого начала термодинамики (δQ=dU+δΑ)следует, что для изотермического процесса
δQ=δΑ,
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
Q =  . (4.15)
. (4.15)
Следовательно, для того чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
– Адиабатический процесс.
Адиабатическим называется процесс, при котором отсутствует теплообмен (δQ =0) между системой и окружающей средой.
К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д. Из первого начала термодинамики для адиабатического процесса следует, что
δQ= – dU,(11.24)
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражения (4.4) и (4.8), для произвольной массы газа перепишем уравнение в виде
pdV=–νCVdT. (11.25)
Продифференцировав уравнение состояния для идеального газа pV=ν RT, получим
pdV + Vdp = νRdT. (11.26)
Исключим температуру Т
 .
.
Разделив переменные и учитывая, что Ср/СV =γ, найдем
dp/p= – γdV/V.
Интегрируя это уравнение в пределах от р 1до p 2 соответственно от V 1до V 2а затем потенцируя, придем к выражению
p 2 /p 1 = (V 1 /V 2) γ,
или p 1  =p 2
=p 2  .
.
Так как состояния 1 и 2выбраны произвольно, то можно записать
pVγ= const. (11.27)
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
Для перехода к переменным Т, V p,Т исключим из (11.27) с помощью уравнения Клапейрона — Менделеева (7.9) соответственно давление или объем:
TV γ– 1 = const, (11.28)
Tγp 1 –γ = const. (11.29)
Выражения (11.27) – (11.29) представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина
γ =Cp/CV= (i +2)/ i, (11.30)
называется показателем адиабаты. Для одноатомных газов (Ne, Не и др.), достаточно хорошо удовлетворяющих условию идеальности, i =3, γ = 1,67. Для двухатомных газов (Н2, N2, О2 и др.) i =5, γ= 1,4. Значения γ, вычисленные по формуле (11.30), хорошо подтверждаются экспериментом.
Диаграмма адиабатического процесса (адиабата) в координатах p, V изображается гиперболой (рис.11.7).
 На рисунке видно, что адиабата (pVγ =const) более крута, чем изотерма (pV =const). Это объясняется тем, что при адиабатическом сжатии 1—3увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
На рисунке видно, что адиабата (pVγ =const) более крута, чем изотерма (pV =const). Это объясняется тем, что при адиабатическом сжатии 1—3увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
Вычислим работу, совершаемую газом в
Рис.11.7. адиабатическом процессе. Запишем уравнение (11.25) в виде
δА=–νCVdT.
Если газ адиабатически расширяется от объема V 1до V 2,то его температура уменьшается от Τ 1до Т 2и работа расширения идеального газа
A=  . (11.31)
. (11.31)
Применяя те же приемы, что и при выводе формулы (11.27), выражение (11.31) для работы при адиабатическом расширении можно преобразовать к виду
A =  . (11.32)
. (11.32)
Работа, совершаемая газом при адиабатическом расширении 1 – 2 (определяется площадью, заштрихованной на рис.11.7, меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом – температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность – они происходят при постоянной теплоемкости.
Дата публикования: 2014-10-04; Прочитано: 2265 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
