 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Растворимость
|
|
Растворимостью называют общую концентрацию вещества в его насыщенном растворе при данной температуре.

Рассмотрим вначале случай, когда малорастворимый электролит присутствует в насыщенном растворе только в виде ионов, образовавшихся при его диссоциации. Обозначим молярную концентрацию малорастворимого электролита в его насыщенном растворе S (моль/л), тогда [A] = mS, [B] = nS.


Для бинарного электролита

Пример 6.2. Рассчитать растворимость (моль/л) Ba(IO3)2 в воде при 25 °С.
Иодат бария является сильным электролитом и переходит в раствор только в виде ионов.
 7,2×10-4 моль/л
7,2×10-4 моль/л
 Рис. 6.2. Равновесия в системе «осадок малорастворимого слабого электролита - насыщенный раствор»
Рис. 6.2. Равновесия в системе «осадок малорастворимого слабого электролита - насыщенный раствор»
|
Многие из малорастворимых электролитов могут находиться в растворе не только в виде ионов, но и в виде молекул (рис. 6.2). Концентрация молекул вещества в его насыщенном растворе называется молекулярной растворимостью (S0). Растворимость таких веществ равна сумме ионной и молекулярной растворимости
Sобщ = [A] + [AB]
Рассмотрим случай, когда вещество может находиться в растворе в виде незаряженного комплекса.


Например, для AgSCN KS = 1,1×10-12, b = 5,6×104
 моль/л (около 5% от Sобщ).
моль/л (около 5% от Sобщ).
Формулу для расчёта S0 слабых кислот можно получить из выражения константы кислотности

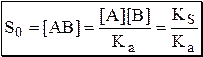
Например, для бензойной кислоты KS = 1,4×10-6, Ka = 6,3×10-5.
 моль/л (около 95% от общей S)
моль/л (около 95% от общей S)
Дата публикования: 2014-10-19; Прочитано: 954 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
