 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Произведение растворимости малорастворимого электролита
|
|
 Рис. 6.1. Равновесие в системе «осадок - насыщенный раствор малорастворимого сильного электролита»
Рис. 6.1. Равновесие в системе «осадок - насыщенный раствор малорастворимого сильного электролита»
|
Рассмотрим гетерогенную систему, состоящую из малорастворимого соединения AmBn, находящегося в осадке, и насыщенного раствора этого вещества (рис. 6.1). Будем считать, что AmBn имеет ионную кристаллическую решётку, является сильным электролитом и переходит в раствор только в виде сольватированных ионов Ax+ и By-:
AmBn¯ › mAx+ + nBy
Как и любое равновесие данный процесс можно описать константой химического равновесия

Активность осадка равна 1, поэтому

При постоянной температуре произведение активностей ионов малорастворимого электролита (в степенях равных соответствующим стехиометрическим коэффициентам) в насыщенном растворе есть для данного растворителя величина постоянная и называется термодинамическим произведением растворимости.
Термодинамическое произведение растворимости подходит для описания идеальных систем либо систем близких к идеальным (нулевая или очень малая ионная сила, отсутствие побочных реакций). На практике чаще используют концентрационное произведение растворимости, которое может быть реальным или условным. Реальное концентрационное произведение растворимости (KS) выражается через равновесные концентрации ионов, образующихся при растворении осадка

Условным концентрационным произведением растворимости ( ) называется произведение (в степенях равных стехиометрическим коэффициентам) общей концентрации всех форм существования катиона малорастворимого электролита и всех форм существования его аниона.
) называется произведение (в степенях равных стехиометрическим коэффициентам) общей концентрации всех форм существования катиона малорастворимого электролита и всех форм существования его аниона.

Условное произведение растворимости удобно использовать в тех случаях, когда ионы, образовавшиеся при растворении малорастворимого электролита, вступают в побочные реакции (протолитические реакции, образование комплексных соединений и т.д.).
Различные виды произведения растворимости связаны между собой следующим образом


По величине произведения растворимости, как и по величине любой константы равновесия, можно определить, достигла система состояния равновесия или нет.

Пример 6.1. Определить, выпадет ли осадок иодата бария при смешивании 10 мл 1,0×10-3 М BaCl2 и 10 мл 2,0×10-3 М KIO3, если 
В конечном растворе: С(Ba2+) = 5,0×10-4 моль/л,  =1,0×10-3 моль/л.
=1,0×10-3 моль/л. 
5,0×10-4 × (1,0×10-3)2 = 5,0×10-10 < 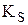
Осадок иодата бария в данных условиях не образуется.
Дата публикования: 2014-10-19; Прочитано: 3481 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
