 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Произведение растворимости. Возьмем какую-либо трудно растворимую соль, например, AgCl и приведем ее в соприкосновение с водой
|
|
Возьмем какую-либо трудно растворимую соль, например, AgCl и приведем ее в соприкосновение с водой. При этом ионы Ag+ и Cl–, испытывая притяжение со стороны близлежащих диполей воды, будут постепенно отрываться от поверхности кристаллов и в виде гидратированных ионов переходить в раствор, т.е. происходит процесс растворения. Наряду с этим происходит и противоположный процесс — осаждения ионов Ag+ и Cl– из раствора. Гидратированные ионы Ag+ и Cl–, сталкиваясь при своем движении с поверхностью кристаллов AgCl, испытывают притяжение со стороны противоположно заряженных ионов кристаллической решетки. Они, в некоторых случаях, дегидратируются (теряют диполи воды) и осаждаются на поверхности кристалла. Протекание взаимно противоположных процессов (растворения и осаждения) приводит к состоянию динамического равновесия, при котором в единицу времени ровно столько ионов Ag+ и Cl– покидает поверхность твердой фазы, сколько их осаждается на поверхности этой фазы из раствора. При наступлении равновесия дальнейшее накопление ионов в растворе, как и их осаждение из раствора, прекращается и получается насыщенный раствор соли. Следовательно, насыщенным раствором называется раствор, находящийся в динамическом равновесии с твердой фазой (осадком).
Напишем выражения для скоростей растворения υ 1 и осаждения υ 2. Скорость υ 1 (т.е. количество ионов, отдаваемых в раствор единицей поверхности твердой фазы в единицу времени) пропорциональна числу ионов, находящихся на единице поверхности. Это число не изменяется с течением времени, поэтому скорость растворения можно считать постоянной при неизменной температуре:
υ 1 = K 1. (8)
Скорость υ 2 (процесса осаждения ионов Ag+ и Cl– на поверхности кристаллов) зависит от числа столкновений этих ионов в единицу времени с единицей поверхности. Если бы в растворе не существовало межионных сил, уменьшающих скорость движения ионов, а значит, и число их столкновений с твердой фазой, то число этих столкновений было бы пропорционально концентрации ионов Ag+ и Cl– в растворе. Чтобы учесть действие межионных сил, надо концентрации ионов заменить их активностями:
υ 2 = K 2 · a Ag+ · a Cl–, (9)
где К 2 – коэффициент пропорциональности, т.е. величина постоянная при данной температуре.
Поскольку при равновесии скорости растворения и осаждения одинаковы, то равны и правые части формул (8) и (9),
следовательно:
K 1 = K 2 · a Ag+ · a Cl–,
откуда можно выразить:
a Ag+ · a Cl– = 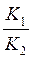 = ПРAgCl.
= ПРAgCl.
Таким образом, произведение активностей ионов данного малорастворимого электролита в насыщенном растворе есть величина постоянная при данной температуре. Эта константа характеризует способность вещества растворяться и называется произведением растворимости, обозначают ее ПР. Растворимость и ПР некоторых малорастворимых электролитов приведены в таблице 5.
Если в уравнении диссоциации электролита коэффициенты, стоящие при отдельных ионах, не равны единице, то значения активностей ионов входят в выражение произведения растворимости в степенях, равных соответствующим коэффициентам:
Ca(PO4)2 = 3Ca2+ + 2PO43–
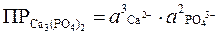
или
Ag2SO4 = 2Ag+ + SO42–
 .
.
5 Таблица
Растворимость и ПР малорастворимых электролитов при температуре 18°С
| Формула вещества | Растворимость (моль/л) | ПР | Формула вещества | Растворимость (моль/л) | ПР |
| Mg(OH)2 | 
| 
| MnS | 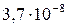
| 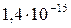
|
| BaCO3 | 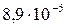
| 
| Zn(OH)2 | 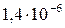
| 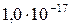
|
| BaC2O4 | 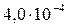
| 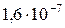
| ZnS | 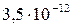
| 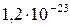
|
| BaCrO4 | 
| 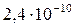
| NiS | 
| 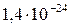
|
| BaSO4 | 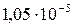
| 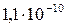
| AgBr | 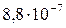
| 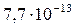
|
| SrCO3 | 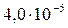
| 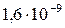
| AgCl | 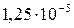
| 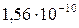
|
| SrC2O4 | 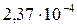
| 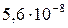
| AgI | 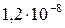
| 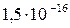
|
| SrSO4 | 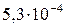
| 
| Ag2S | 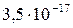
| 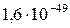
|
| CaCO3 | 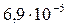
| 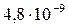
| PbCl2 | 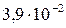
| 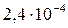
|
| CaC2O4 | 
| 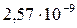
| PbI2 | 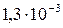
| 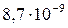
|
| CaSO4 | 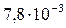
| 
| PbS | 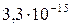
| 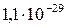
|
| Fe(OH)2 | 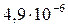
| 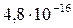
| PbSO4 | 
| 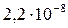
|
| Fe(OH)3 | 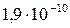
| 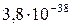
| HgS | 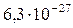
| 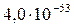
|
| FeS | 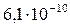
| 
| CuS | 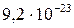
| 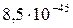
|
| Mn(OH)2 | 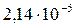
| 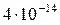
| CdS | 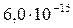
| 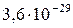
|
Так как активности ионов равны их концентрациям, умноженным на коэффициент активности f для соответствующего иона, то выражение ПРAgCl можно записать в следующем виде:
ПРAgCl = f Ag+ ·[Ag+] · f Cl– ·[Cl-].
Поскольку AgCl — очень мало растворимое вещество, то концентрация его ионов в насыщенном растворе также очень мала, а межионные силы практически не играют роли. Поэтому без заметной погрешности коэффициенты активности можно принять равными единице:
f Ag+ = f Cl– = 1.
При этом получим приближенное уравнение, которое вполне удовлетворительно можно использовать в практических расчетах:
ПРAgCl = [Ag+]·[Cl–].
1.2. Влияние одноименных ионов на растворимость
и солевой эффект
Согласно правилу произведения растворимости, в тот момент, когда произведение концентраций ионов (в общем случае — активностей ионов) данного малорастворимого электролита (так называемое «ионное произведение») достигнет величины произведения растворимости при данной температуре, раствор этого электролита становится насыщенным. Если ионное произведение меньше произведения растворимости, и раствор имеет меньшую концентрацию, чем в состоянии насыщения, он является ненасыщенным.
Если ионное произведение превысит произведение растворимости, раствор станет пересыщенным и должен будет часть вещества выделить в виде осадка. Например, для AgCl имеем:
1) в насыщенном растворе: [Ag+]·[Cl–] = ПРAgCl
2) в ненасыщенном растворе: [Ag+]·[Cl–] < ПРAgCl
3) в пересыщенном растворе: [Ag+]·[Cl–] > ПРAgCl
Можно ненасыщенный раствор электролита сделать насыщенным и даже пересыщенным, прибавляя к нему электролит с одноименным ионом. Например, если к ненасыщенному раствору PbCl2 добавлять понемногу HCl или NaCl, то ионное произведение, бывшее сначала меньшим, чем ПР, (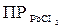 =2,4
=2,4 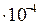 ) постепенно достигнет и, наконец, превысит указанное значение ПР. Раствор из ненасыщенного превратится в насыщенный, а затем пересыщенный раствор.
) постепенно достигнет и, наконец, превысит указанное значение ПР. Раствор из ненасыщенного превратится в насыщенный, а затем пересыщенный раствор.
Таким образом, растворимость малорастворимых электролитов понижается при введении в их растворы каких-либо сильных электролитов с одноименным ионом.
Опыт показывает, что на растворимость электролитов влияют также и те соли, которые не имеют с электролитом общего иона. Например, растворимость PbSO4 в присутствии таких солей, как KNO3, NaNO3, повышается и тем сильней, чем выше концентрация соли. Это явление называется солевым эффектом.
Солевой эффект легко объясняется, если использовать точное уравнение ПР:
[Pb+2][SO42-]·  ,
,
откуда следует, что:
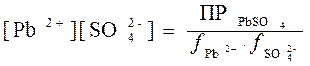 .
.
Поскольку величина 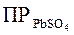 постоянна, а коэффициенты активности
постоянна, а коэффициенты активности 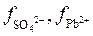 при введении в раствор каких угодно ионов обычно понижаются (табл. 6) из-за возрастания межионных сил взаимодействия, то произведение [Pb2+][SO42–], а, следовательно, и растворимость PbSO4 возрастают. Физическая причина этого явления заключается в том, что стесненные в своих движениях межионными силами, ионы Pb2+ и SO42– будут реже сталкиваться с поверхностью кристаллов PbSO4. Это дает процессу растворения перевес над процессом осаждения ионов из раствора.
при введении в раствор каких угодно ионов обычно понижаются (табл. 6) из-за возрастания межионных сил взаимодействия, то произведение [Pb2+][SO42–], а, следовательно, и растворимость PbSO4 возрастают. Физическая причина этого явления заключается в том, что стесненные в своих движениях межионными силами, ионы Pb2+ и SO42– будут реже сталкиваться с поверхностью кристаллов PbSO4. Это дает процессу растворения перевес над процессом осаждения ионов из раствора.
6 Таблица
Значения коэффициентов активности
| Ионная сила раствора, m | 0,001 | 0,005 | 0,01 | 0,05 | 0,1 |
| Значения f для однозарядных ионов | 0,96 | 0,95 | 0,93 | 0,85 | 0,80 |
| Значения f для двухзарядных ионов | 0,86 | 0,80 | 0,74 | 0,56 | 0,46 |
1.3. Растворимость осаждаемого соединения
и образование осадков
Особенно полезно использование правила ПР в тех случаях, когда соответствующий осадок образуется в результате химической реакции. Например, смешаем раствор соли свинца с раствором NaCl. При этом станет возможным образование осадка PbCl2. Но будет или не будет происходить это осаждение в действительности, зависит от того, окажется ли раствор соли пересыщенным. Это произойдет, только если ионное произведение [Pb2+][Cl–]2 превысит величину 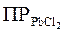 , равную 2,4
, равную 2,4 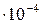 . Исходя из правила ПР можно рассчитать теоретически, будет ли выпадать осадок этой соли. Например, при смешении равных объемов 0,1М растворов Pb(NO3)2 и NaCl объем раствора увеличится вдвое, а концентрации каждого вещества вдвое уменьшатся, т.е. концентрации ионов составят:
. Исходя из правила ПР можно рассчитать теоретически, будет ли выпадать осадок этой соли. Например, при смешении равных объемов 0,1М растворов Pb(NO3)2 и NaCl объем раствора увеличится вдвое, а концентрации каждого вещества вдвое уменьшатся, т.е. концентрации ионов составят:
[Pb2+] = 0,05 моль/л; [Cl–] = 0,05 моль/л.
Ионное произведение для полученной смеси растворов вычислим из выражения:
[Pb2+][Cl–]2 = 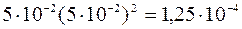 .
.
Рассчитанная величина ионного произведения меньше величины 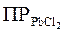 = (
= (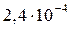 ), поэтому раствор является ненасыщенным, осадок не выпадает.
), поэтому раствор является ненасыщенным, осадок не выпадает.
При смешении 0,1М раствора Pb(NO3)2 с 1М раствором NaCl концентрации ионов составят:
[Pb2+] = 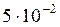 моль/л; [Cl–] = 0,5 =
моль/л; [Cl–] = 0,5 = 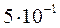 моль/л.
моль/л.
Ионное произведение будет равно:
[Pb2+][Cl–]2 = 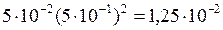 .
.
Полученная величина намного превышает произведение растворимости PbCl2 , равное 2,4·10–4. Поэтому раствор соли PbCl2 является пересыщенным и часть соли выпадет в осадок.
В ряде случаев большое значение имеет полнота осаждения, например, когда ставится задача выделить ценный компонент из раствора или при осуществлении гравиметрического метода химического анализа, когда исследуемое вещество или ион необходимо перевести из растворенного состояния в осадок (по массе осадка судят затем о содержании вещества в растворе).
Совершенно нерастворимых в воде веществ не существует, и величина произведения растворимости никогда не равна нулю, поэтому, ни одно осаждение иона не может быть совершенно полным. Всегда часть осаждаемого иона, соответствующая величине ПР осаждаемого соединения, остается в растворе. Если эта часть очень мала, условно можно считать осаждение практически полным. Но нередки случаи, когда даже условно осаждение не является полным.
Осаждение всегда тем полнее, чем меньше растворимо соединение, в виде которого осаждается ион. Например, ион Pb2+ можно осадить в виде хлорида, сульфата или сульфида. Данные по растворимости этих солей и величины ПР приведены в таблице 7.
7 Таблица
| Вещество | PbCl2 | PbSO4 | PbS |
| Растворимость, моль/л | 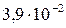
| 
| 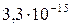
|
| ПР | 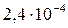
| 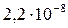
| 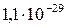
|
Из сопоставления приведенных значений видно, что наиболее растворимым соединением является хлорид, а наименее растворимым — сульфид свинца. Следовательно, в виде PbS свинец может быть осажден наиболее полно, а в виде PbCl2 — наименее полно.
Дата публикования: 2014-11-18; Прочитано: 1191 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
