 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Вычислить ПРAgCl, если известно, что насыщенный раствор AgCl содержит 1,8 10–3 г этой соли в 1л при 25°С
|
|
Пример 1. Вычислить ПРAgCl, если известно, что насыщенный раствор AgCl содержит 1,8 10–3 г этой соли в 1л при 25°С.
Решение. Определим молярную концентрацию насыщенного раствора AgCl:
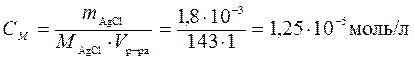 ,
,
где М AgCl — молярная масса хлорида серебра, 143 г/моль.
Поскольку каждая молекула AgCl дает при растворении по одному иону Ag+ и Cl–, (это так называемый бинарный электролит), то концентрации ионов Ag+ и Cl– в насыщенном растворе соли будут такими же:
[AgCl] = [Ag]+ = [Cl–] =  моль/л.
моль/л.
Поэтому рассчитываем ПР:
ПРAgCl= [Ag+] [Cl–] =  .
.
Пример 2. Вычислить  , если насыщенный раствор при 25°С содержит
, если насыщенный раствор при 25°С содержит 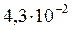 г этой соли в 1л.
г этой соли в 1л.
Решение. Вычислим молярную концентрацию насыщенного раствора Ag2CrO4:
 ,
,
где 332 — молярная масса хромата серебра, г/моль.
Так как из одной молекулы Ag2CrO4 при растворении образуется 2 иона Ag+ и один ион CrO42–:
Ag2CrO4 = 2Ag+ + CrO42–,
то их концентрации в насыщенном растворе составят:
[CrO42–] =  моль/л,
моль/л,
[Ag+] = 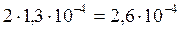 моль/л.
моль/л.
Рассчитываем ПР:
ПРAgCl= [Ag+]2·[CrO42–] = 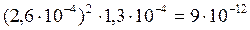 .
.
Обратите внимание на то, что растворимость AgCl (1,25·10–5) меньше, чем растворимость Ag2CrO4 ( ). Это объясняется тем, что при вычислении
). Это объясняется тем, что при вычислении  приходится возводить в квадрат малую величину — концентрацию ионов Ag+ (
приходится возводить в квадрат малую величину — концентрацию ионов Ag+ ( ), чего не делается при вычислении ПРAgCl.
), чего не делается при вычислении ПРAgCl.
Таким образом, о сравнительной растворимости каких-либо электролитов можно судить по величинам их произведений растворимости только в тех случаях, когда их формулы построены однотипно: AgCl, BaSO4, CaCO3 или Ag2CrO4, Ag2CO3, PbI2.
Пример 3. Определить растворимость Mg(OH)2 при 25°С, если произведение растворимости его равно  .
.
Решение. Примем искомую величину — растворимость Mg(OH)2 за х моль/л.
Уравнение диссоциации:
Mg(OH)2 = Mg2+ + 2OH–.
В результате диссоциации х молей Mg(OH)2 в растворе создаются следующие концентрации ионов:
[Mg+2] = x; [OH–] = 2 x.
Тогда:
 ;
;
 ;
;
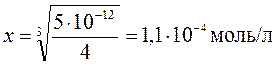 .
.
Чтобы определить растворимость в г/л, необходимо найденную величину умножить на молярную массу Mg(OH)2, которая равна 58 г/моль:
Растворимость Mg(OH)2 = 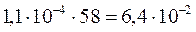 г/л.
г/л.
Пример 4. Рассчитать растворимость йодата бария Ba(IO3)2 в 0,03 М растворе Ba(NO3)2 приближенно и с учетом коэффициентов активности ионов.
Дата публикования: 2014-11-18; Прочитано: 2418 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
