 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Решение. При диссоциации соли на один ион Ва2+ образуется 2 иона IO–3:
|
|
1) Приближенный расчет
При диссоциации соли на один ион Ва2+ образуется 2 иона IO–3:
Ba(IO3)2 = Ba2+ + 2IO3–.
Поскольку концентрация насыщенного раствора Ba(IO3)2 при температуре 25°С равна 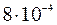 моль/л, то
моль/л, то
[Ba2+] =  моль/л;
моль/л;
[IO3–] = 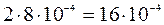 моль/л;
моль/л;
и следовательно:
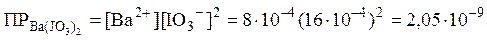 .
.
Обозначим растворимость Ba(IO3)2 в присутствии Ba(NO3)2 через х моль/л. Тогда концентрация ионов [IO3–] = 2 х.
Концентрация ионов Ва2+ складывается из ионов, образующихся при диссоциации раствора Ba(NO3)2 и ионов, образующихся в результате растворения осадка Ba(IO3)2 (их концентрация равна х). Следовательно, в присутствии 0,03М Ba(NO3)2 произведение растворимости Ba(IO3)2 составит:
[Ba+2][IO3–]2 = (0,03 + х)(2 х)2 = 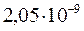 .
.
По сравнению с величиной 0,03, величиной х, как очень малой, можно пренебречь; тогда:
0,12 х 2 = 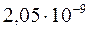 ,
,
откуда
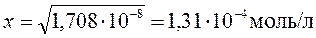 .
.
Следовательно, расчет по упрощенной формуле ПР дает, что растворимость Ba(IO3)2 при замене воды 0,03 М раствором Ba(NO3)2 понизится с 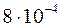 моль/л до
моль/л до  , т.е. примерно
, т.е. примерно
в 6 раз.
2) Расчет с учетом коэффициентов активности
Произведем вычисления по точной формуле:
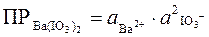
Для определения активностей ионов необходимо величины их концентраций умножить на коэффициенты активности. Коэффициенты активности зависят от ионной силы раствора, которая определяется по формуле:
 ,
,
где С — молярные концентрация ионов; z — их степень окисления.
Определим ионную силу в насыщенном растворе Ba(IO3)2:
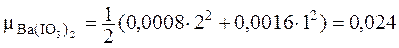 .
.
Путем интерполяции величин коэффициентов активности, приведенных в таблице Х, найдем, что ионной силе 0,0024 отвечают значения  = 0,84;
= 0,84;  = 0,96.
= 0,96.
Интерполяцию производим следующим образом. Значение
m = 0,0024 лежит между значениями 0,001 и 0,005, разница между которыми 0,004. Этой разнице в величинах mдля двухвалентных ионов отвечает уменьшение f от 0,86 до 0,8, т.е. 0,06. Составим пропорцию:
0,004 —— 0,06
0,0014 —— х;
откуда 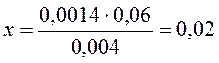 .
.
Затем рассчитываем:
f Ba2+=0,86 – 0,02 = 0,84.
Аналогично производим расчет коэффициент активности для иодат-иона.
Рассчитываем активности ионов:
a Ba2+= 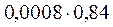 ;
;
a IO3– = 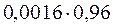 .
.
Точное значение ПР соли составит:
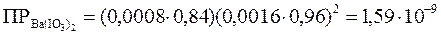 .
.
Из найденной точной величины 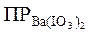 , вычислим растворимость Ba(IO3)2 в 0,03М растворе Ba(NO3)2. Для этого снова определим ионную силу раствора. Поскольку Ba(IO3)2 дает в раствор очень мало ионов по сравнению с Ba(NO3)2, для вычисления ионной силы можно учитывать только присутствие Ba(NO3)2:
, вычислим растворимость Ba(IO3)2 в 0,03М растворе Ba(NO3)2. Для этого снова определим ионную силу раствора. Поскольку Ba(IO3)2 дает в раствор очень мало ионов по сравнению с Ba(NO3)2, для вычисления ионной силы можно учитывать только присутствие Ba(NO3)2:
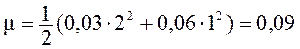 .
.
Этой ионной силе отвечают следующие значения коэффициентов активности ионов:  = 0,48;
= 0,48;  =0,81.
=0,81.
Обозначим неизвестную нам величину молярной концентрации Ba(IO3)2 через х, при этом [IO3-] =2 х.
 ;
;
х = 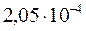 моль/л.
моль/л.
Таким образом, при точном вычислении получается, что в присутствии 0,03 моль/л Ba(NO3)2 растворимость Ba(IO3)2 понизится с 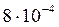 моль/л до
моль/л до 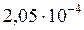 моль/л, т.е. в 4 раза (вместо шестикратного уменьшения, полученного при приближенном расчете).
моль/л, т.е. в 4 раза (вместо шестикратного уменьшения, полученного при приближенном расчете).
Дата публикования: 2014-11-18; Прочитано: 1052 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
