 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Закон действующих масс. Вывод константы равновесия для гомогенной реакции
|
|
Многие химические реакции, в зависимости от условий, могут термодинамически протекать самопроизвольно как в прямом так и в обратном направлении. Состав равновесной реакционной смеси характеризуется тем, что концентрации исходных веществ и конечных продуктов находятся по отношению друг к другу в определённом динамическом равновесии.
Основным законом кинетики является закон действующих масс, открытый в 1867 г. К.Гульбергом и П.Вааге: Скорость односторонней химической реакции прямопропорциональна произведению концентрации реагирующих веществ, взятых в степенях, соответствующих стехиометрическим коэффициентам. Частная формулировка закона была дана Н. Н. Бекетовым в 1865 г. при изучении давления водорода на скорость вытеснения им металлов из их солей.
Химические реакции подразделяются на гомогенные и гетерогенные.
Гомогенными называются реакции, протекающие в одной фазе: в смеси газов, в жидком или иногда в твёрдом растворе.
Например:
CO (г) + Н2O (г) Û CO2 (г) + H2 (г),
CH3COOH (ж) + C2H5OH (ж) Û CH3COOC2H5 (ж) + H2O (ж) .
Гетерогенными называются реакции, протекающие на границе раздела двух фаз: твёрдое тело – жидкость, твёрдое тело – газ, твёрдое тело – твёрдое тело, жидкость – жидкость.
Например:
CaO (т) + CO2 (г) Û CaCO3 (г),
C (т) + O2 (г) Û CO2 (г).
Рассмотрим обратимую гомогенную реакцию:
aA + bB Û dD + eE,
протекающую между веществами в изобарно-изотермических условиях (Р = const и Т = const).
Согласно закону действия масс скорости прямой (V1) и обратной (V2) реакции определяются уравнениями:
V1 = k1 CaA CbB,
V2 = k2 CdD CeE,
где k1 и k2 – константы скорости прямой и обратной реакций; CA, CB, CD, CЕ – равновесные концентрации участников реакции; a, b, e, d – стехиометрические коэффициенты; A, B, E, D – участники реакции.
В состоянии равновесия скорости прямой и обратной реакций одинаковы:
V1 = V2.
Имея равенство левых частей уравнения, приравниваем их правые части:
k1 CaA CbB = k2 CdD CeE.
Разносим в разные стороны константы скорости реакций и равновесные концентрации и получаем:
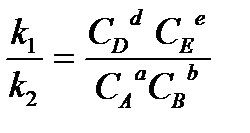 .
.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Константа химического равновесия показывает во сколько раз скорость прямой реакции больше скорости обратной реакции:
Кравн = 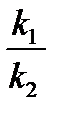 .
.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех участников реакции связаны между собой. Изменение концентрации любого из них вызывает изменение концентраций всех остальных; в результате устанавливаются другие концентрации, но константа равновесия данной химической реакции остаётся величиной неизменной.
Таким образом константа равновесия – это постоянная величина, равная отношению произведений равновесных концентраций конечных и исходных участников реакции, взятых в степенях, соответствующих стехиометрическим коэффициентам.
Дата публикования: 2014-11-18; Прочитано: 2689 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
