 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Уравнение Гиббса – Гельмгольца
|
|
Рассмотрим изохорно-изотермическую систему (Т = const; V = const) и воспользуемся для характеристики этой системы функцией F = U – T·S. Так как 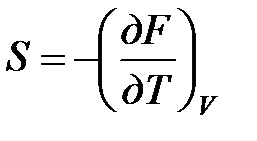 , то, подставив это значение в уравнение функции свободной энергии, получим
, то, подставив это значение в уравнение функции свободной энергии, получим 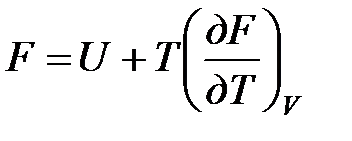 .
.
Рассмотрим изотермический переход системы из начального состояния в конечное, для которых 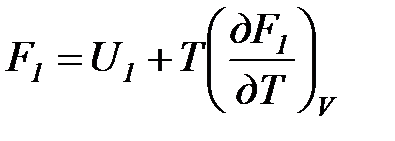 ;
; 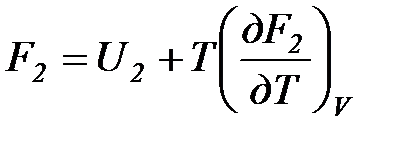 .
.
Но 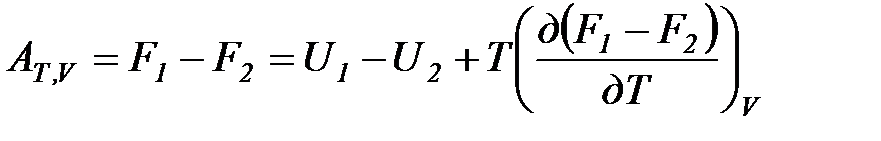
и 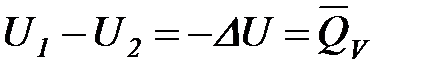 ,
,
поэтому 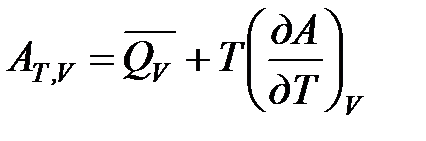 (1)
(1)
или 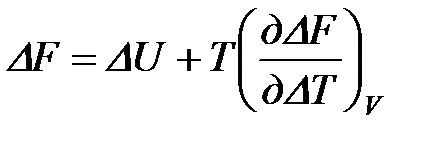 .
.
Анализируя протекание процесса в изобарно-изотермических условиях (Т = const; р = const), путем аналогичных рассуждений придем к выводу, что  (2)
(2)
или 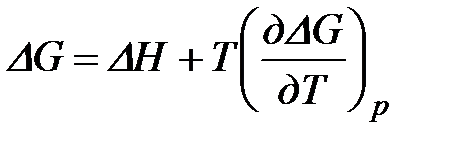 .
.
Уравнения (1) и (2) выражают величину максимальной работы через тепловой эффект реакции и называются уравнениями Гиббса-Гельмгольца.
Из уравнений видно, что теплота может служить мерой химического сродства только при Т = 00 К или при 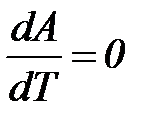 , т. е. при независимости величины работы от температуры.
, т. е. при независимости величины работы от температуры.
Применение второго закона термодинамики к фазовым превращениям. Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения. Интегрирование уравнения Клаузиуса - Клапейрона и его анализ.
Дата публикования: 2014-11-18; Прочитано: 3542 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
