 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Связь между различными формами выражения констант равновесия
|
|
Константа химического равновесия может быть выражена различными способами. Если Кравн выражается через равновесные концентрации, то она обозначается Кс и рассчитывается по уравнению:
 .
.
Если реакция протекает в газовой фазе, то константу равновесия можно выразить через равновесные парциальные давления участников реакции:
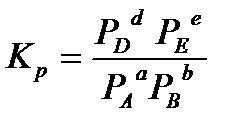 .
.
Константу равновесия можно выразить через числа молей (n) участников реакции:
 ,
,
и их мольную долю (N):
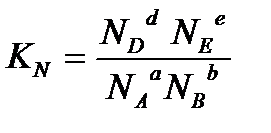 .
.
Учитывая соотношение между парциальными давлением (Рi, н/м), концентрацией (Сi, моль/м3), числом молей (ni) и мольной долей (Ni) i – компонента.
Рi = Ci RT = NiPобщ = 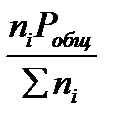 ni =
ni =  ,
,
можно вывести формулы связи констант равновесия, выраженных различным способом:
Кр = Кс (RT) Dn,
Kp = KN Pобщ Dn,
Кр = Кn  .
.
Dn равна разности между стехиометрическими коэффициентами конечных и начальных газообразных веществ в соответствии с уравнениями реакции и определяется по уравнению: Dn = е + d – a – b.
Таким образом, если Dn ¹ 0 и реакция сопровождается изменением числа молей, то имеет место соотношение:
Кр = Кс(RT) Dn = KNPобщDn = Kn 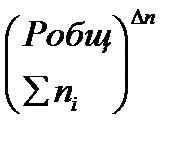 = Kn
= Kn 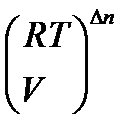 .
.
Константы равновесия Кn и KN зависят от общего давления. Если Dn = 0, то все константы равновесия численно равны друг другу при любом способе их вычисления:
Кр = Кс = KN = Кn.
Химическое равновесие в гетерогенных системах. Расчет константы равновесия. Химическое сродство как мера реакционноспособности системы. Изотерма Вант-Гоффа. Нормальное химическое сродство.
Дата публикования: 2014-11-18; Прочитано: 1927 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
