 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Избирательность адсорбции
|
|
Адсорбция растворенных веществ твердыми адсорбентами – более сложный процесс, чем адсорбция газов твердыми телами, поскольку она осложняется рядом факторов:
1) присутствием третьего компонента – растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента;
2) взаимодействием между молекулами адсорбата и растворителя;
3) электростатическим взаимодействием между поверхностью адсорбента и ионами адсорбата, если он является электролитом.
Адсорбция неэлектролитов и слабых электролитов. Явление адсорбции из растворов твердыми телами было открыто и изучено в 1785 г. русским химиком Т.Е.Ловицем (1757 – 1804).
Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией. В результате адсорбции концентрация растворенного вещества в растворе уменьшается. Величину адсорбции из раствора можно определить по разности исходной и равновесной концентраций адсорбата в растворе:
Г = 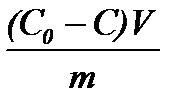 (8.1),
(8.1),
где С0 –исходная концентрация адсорбата, моль×л–1; С –равновесная концентрация адсорбата, моль×л–1; V – объем раствора адсорбата, из которого происходила адсорбция, л; m – масса адсорбента, кг; Г – адсорбция, моль×кг–1.
С повышением температуры адсорбция уменьшается, поскольку ∆Hадс < 0, однако могут быть исключения для некоторых узких диапазонов температур, когда адсорбция с увеличением температуры возрастает. Это происходит в случае, если с увеличением температуры растворимость адсорбата значительно снижается. Зависимость адсорбции от концентрации адсорбата может иметь разную форму. Наиболее часто для описания процессов используют уравнения Лэнгмюра и Фрейндлиха.
Ионная адсорбция на твердой поверхности наблюдается при соприкосновении этой поверхности с растворами электролитов. Ионы одного знака удерживаются на поверхности адсорбента сильнее, чем ионы другого знака. Это определяется электростатическими и химическими силами, которые зависят от свойств поверхности и ионов.
В данном случае адсорбция зависит от природы адсорбента и растворителя, от природы и концентрации адсорбата, от температуры, а также от удельной поверхности адсорбента.
П.А.Ребиндер (1898 – 1972) сформулировал правило выравнивания полярностей: на полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей; на неполярных адсорбентах – неполярные адсорбаты из полярных растворителей.
Для системы адсорбат–адсорбент влияние природы растворителя на адсорбцию можно также сформулировать в виде правила: чем лучше в данном растворителе растворяется данный адсорбат, тем он хуже адсорбируется; чем хуже растворяется – тем лучше из него адсорбируется.
Эти правила можно объяснить тем, что процесс адсорбции из растворов обусловливается энергией взаимодействия не только между молекулами адсорбата и активными адсорбционными центрами адсорбента, но и между молекулами растворителя и активными адсорбционными центрами.
С ростом концентрации раствора адсорбция на границе раздела твердое тело–раствор возрастает до некоторого предельного значения.
При адсорбции ПАВ на границе раздела твердое тело – раствор так же, как и на границе раствор–газ, молекулы адсорбата ориентированы по–различному в зависимости от природы адсорбента и растворителя.
В системе неполярный адсорбент – полярный растворитель неполярная часть молекулы адсорбата («хвост») обращена к поверхности адсорбента, а полярная часть («голова») погружена в растворитель. В этом случае адсорбция ПАВ подчиняется правилу Дюкло – Траубе: с ростом длины углеводородного радикала адсорбция увеличивается.
В системе полярный адсорбент – неполярный растворитель молекулы адсорбата, наоборот, обращены полярной частью к поверхности адсорбента, а неполярная их часть погружена в растворитель, и при адсорбции ПАВ выполняется обращенное правило Дюкло – Траубе: с ростом длины углеводородного радикала адсорбция уменьшается. Обращение правила объясняется тем, что с ростом длины углеводородной цепочки растет растворимость ПАВ в неполярных растворителях.
Адсорбция сильных электролитов. В растворах сильных электролитов растворенное вещество находится в полностью ионизированном состоянии. Поэтому для их адсорбции характерен ряд особенностей, например, ионы адсорбируются в основном на полярных адсорбентах и плохо адсорбируются на неполярных.
Основными факторами, обусловливающими специфичность адсорбции сильных электролитов, являются знак заряда поверхности адсорбента, величина и знак заряда иона электролита, а также его радиус и степень сольватации (гидратации). На положительно заряженных участках поверхности адсорбента из раствора адсорбируются анионы, на отрицательно заряженных – катионы.
Установлено, что адсорбционная способность ионов (особенно катионов) на поверхности адсорбента возрастает с увеличением их заряда. Экспериментально также установлено следующее правило: при одинаковых зарядах адсорбционная способность больше у тех ионов, радиус которых в сольватированном (гидратированном) состоянии меньше. Согласно этому правилу, ионы по адсорбционной способности располагаются в определенной последовательности, получившей название лиотропных рядов
Различают следующие виды адсорбции сильных электролитов: избирательную и обменную. Избирательная адсорбция подчиняется правилу Фаянса-Панета: на поверхности данного адсорбента адсорбируются преимущественно ионы, родственные природе адсорбента и способные достраивать его кристаллическую решетк у. Иллюстрацией правила Фаянса может служить зарядка поверхности кристаллического осадка серебра иодидa, полученного в результате следующей реакции: KI(p) + AgNO3(p) = AgI(т) + KNO3(p)
Поверхность осадка при эквивалентных количествах KI и AgNO3 не заряжена (рис.8.1а); при избытке AgNO3 заряжается положительно вследствии адсорбции ионов Ag+ (рис.8.1б), а при избытке KI– отрицательно из-за адсорбции I––ионов (рис.8.1в).

Рис. 8.1. Возникновение заряда на поверхности адсорбента (кристаллов AgI) вследствие избирательной адсорбции ионов из раствора:
a) C(AgNO3) = C(KI); б) C(AgNO3) > C(KI); в) C(AgNO3) < C(KI)
Ионообменная адсорбция представляет собой процесс, при котором ад-сорбент и раствор обмениваются между собой одноименно заряженными ионами в эквивалентных количествах. Адсорбенты, способные к обмену ионами, называются ионитами. Иониты представляют собой вещества, способные к ионному обмену при контакте с растворами электролитов. По знаку обмениваемых ионов различают катиониты и аниониты. Они состоят из каркаса (матрицы), который обладает определенным зарядом и ионом, способным к обмену. Катионит имеет закрепленные анионогенные группы и катионы, способные к обмену с окружающей средой. Аниониты содержат закрепленные катионогенные группы и способные к обмену анионы.
Дата публикования: 2014-11-19; Прочитано: 3759 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
