 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Опыт № 3. Исследование процесса коагуляции золя «берлинской лазури» с положительно заряженными частицами
|
|
Поскольку коллоидный раствор имеет положительно заряженные коллоидные частицы, то его коагуляцию должны вызывать анионы, причем, тем быстрее, чем выше заряд аниона.
В качестве электролитов – коагуляторов используют растворы:
0,1 М КСl, 0,0025 М К2SO4 и 0,001 М К3PO4.
1. Первый опыт проводят с электролитом 0,1 М раствором KCl. Для этого в пять пробирок первого штатива наливают указанное количество раствора 0,1 М КCl и разбавляют дистиллированной водой до 5,0 мл. Необходимые объемы раствора электролита – коагулятора и воды указаны в таблице 1.
В каждую пробирку быстро приливают по 5,0 мл полученного золя «берлинской лазури». Следят за тем, чтобы общий объем раствора в каждой пробирке оставался постоянным (Vобщ = 10,0 мл). Через 30-40 минут отмечают, в каких пробирках прошла явная коагуляция. При «помутнении» раствора в таблице 1 ставят знак «+».
2. Аналогично исследуют процесс коагуляции золя электролитами 0,0025 М К2SO4 и 0,001М К3PO4, проводя второй и третий опыт с соответствующими электролитами. Для этого в пять пробирок второго и третьего штативов наливают растворы данных электролитов в количестве, указанном в таблице 1.
В каждую из пяти пробирок приливают по 5,0 мл полученного золя «берлинской лазури». Следят за тем, чтобы общий объем раствора оставался постоянным. Через 30-40 минут отмечают, в каких пробирках прошла явная коагуляция. При «помутнении» раствора в пробирках в таблице 2 ставят знак «+».
3. Рассчитывают порог коагуляции (γ, моль/л) по следующему уравнению:
γ = 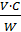
где V– объем электролита, вызывающего коагуляцию, мл; С- концентрация электролита, моль/л; W- объем золя, мл.
Таблица
Условия и результаты эксперимента
| № | Условия эксперимента | Результаты эксперимента | ||||||||||
| Объем, мл | KCl | ВаСl2 | AlCl3 | |||||||||
| вода | эл-т | золь | Сэ | +/- | γ | Сэ | +/- | γ | Сэ | +/- | γ | |
4. Проверяют правило Шульце – Гарди. Значение показателя степени заряда иона-коагулятора (n) рассчитывают графическим способом. Для этого уравнение γ =  приводят к линейному виду (логарифмируют).
приводят к линейному виду (логарифмируют).
lg γ = lg const- nlg z
Строят график в координатах lg γ = f (lg z). Тогда тангенс угла наклона прямой равен tg(π -ψ) = n.
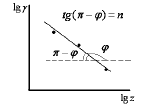
Рассчитывают значение показателя степени заряда иона- коагулятора и сравнивают его с теоретическим значением.
Контрольные вопросы и задания
1. Из каких составляющих складывается баланс свободной энергии при диспергировании лиофильных и лиофобных систем?
2. Какими способами можно нарушить устойчивость коллоидной системы? Повысить устойчивость коллоидной системы?
3. Чем обусловлена агрегативная неустойчивость лиофобных дисперсных систем? Какие процессы самопроизвольно идут в таких системах?
4. В чем отличие диспергирования от пептизации?
5. Факторы, под действием которых может происходить коагуляция.
6. Нейтрализационная и концентрационная коагуляция.
7. Влияние температуры на электрокинетический потенциал и агрегативную устойчивость лиофобных дисперсных систем.
8. Влияние природы среды на электрокинетический потенциал и агрегативную устойчивость лиофобных дисперсных систем.
9. Влияние добавок индифферентных электролитов на электрокинетический потенциал и агрегативную устойчивость золей.
10. Влияние добавок неиндифферентных электролитов на электрокинетический потенциал и агрегативную устойчивость золей.
Понятие устойчивости лиофобных дисперсных систем. Факторы, определяющие устойчивость гидрозолей.
12. Коагуляция коллоидных систем. Основные закономерности электролитной коагуляции.
13. Правило Шульце-Гарди. Лиотропные ряды. Явление неправильных лиотропных рядов.
14. Закономерности коагуляции смесью электролитов.
15. Какой объем раствора Ba(NO3)2 с концентрацией 0,05 М требуется для коагуляции 1 л золя AgI? Порог коагуляции 2·10–3 М.
16. Пороги коагуляции гидрозоля гидрооксида железа (III) сульфатом натрия и хлоридом калия соответственно равны 0,32 и 20,50 ммоль/л. Определите знак заряда коллоидных частиц золя. Вычислите коагулирующую способность этих электролитов и сопоставьте их соотношение с вычисленными по правилу Шульце – Гарди.
Дата публикования: 2014-11-19; Прочитано: 1110 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
