 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Энергия Гиббса смеси идеальных газов. Определение химического потенциала
|
|
Энергия Гиббса является экстенсивной функцией, что позволяет рассчитать ее значение для смеси идеальных газов.
Представим себе резервуар, разделенный перегородками на секции, как показано на рис.8.
В каждую секцию помещают индивидуальный газ, причем все они имеют различную природу. Объем каждой секции равен V 1, V 2.. .Vi, объем всего резервуара равен V = V 1 + V 2 +... + Vi. Число молей каждого газа n 1, n 2.. .ni. Во всех секциях газы имеют одинаковую температуру Т = const и одинаковое давление Р = const.

Рис. 8. Резервуар, разделенный на секции и заполненный газами разной природы
при Т = const и Р = const.
До перемешивания газов суммарная энергия Гиббса будет равна сумме энергий Гиббса всех газов, находящихся в отдельных секциях.
После удаления перегородок между секциями газы разной природы самопроизвольным образом перемешиваются вследствие процесса диффузии и все газы равномерно распределяются по объему резервуара V. Каждый газ в полученной смеси будет характеризоваться парциальным давлением Pi, причем P 1 + P 2 +... + Pi = Pобщ..
Из определения энергии Гиббса (III, 18) следует:
G = U + PV – TS
Рассмотрим в этом выражении каждое слагаемое.
Согласно уравнению (I, 28) зависимость внутренней энергии 1 моль индивидуального i - ого вещества от температуры представляется следующим образом:
 (III, 43)
(III, 43)
где CVi — молярная теплоёмкость при постоянном объёме i - ого газа. Так как для идеального газа теплоёмкость CVi не зависит от температуры, интегрируя при этом условии уравнение (III, 43) от нуля до Т, получим:
 или
или 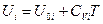 (III, 44)
(III, 44)
где U 0 i — внутренняя энергия 1 моль i - ого вещества при 0 К. Если в смеси этого вещества содержится ni моль, то умножая обе части уравнения (III, 44) на ni и суммируя по всем индивидуальным веществам системы, будем иметь:
 (III, 45)
(III, 45)
Второе слагаемое в выражении для энергии Гиббса, исходя из уравнения Менделеева — Клапейрона, запишем в виде:
 (III, 46)
(III, 46)
Рассмотрим третье слагаемое. Из уравнения (II, 23) для 1 моль идеального газа следует:
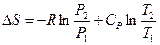
Положим 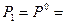 1 атм и T 1 = 1 K, тогда
1 атм и T 1 = 1 K, тогда
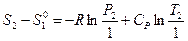 или
или 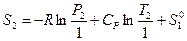 (III, 47),
(III, 47),
где  — стандартная (так как относится к P 0 = 1 атм.) энтропия 1 моль идеального газа при 1 К, которая также называется энтропийной постоянной идеального газа. Индекс «2» теперь можно отбросить и выражение запишется в виде:
— стандартная (так как относится к P 0 = 1 атм.) энтропия 1 моль идеального газа при 1 К, которая также называется энтропийной постоянной идеального газа. Индекс «2» теперь можно отбросить и выражение запишется в виде:
 ,
,
где  — относительное давление. Стоящие под знаком логарифма величины
— относительное давление. Стоящие под знаком логарифма величины  и
и 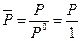 — безразмерные. Следует отметить, что величины P и P 0 могут быть выражены в любых, но обязательно одних и тех же единицах — атмосферах, паскалях, миллиметрах ртутного столба (торричелли) и т. д. Однако выражение давления в атмосферах имеет очевидное преимущество, т. к. в этом случае давление и относительное давление численно совпадают
— безразмерные. Следует отметить, что величины P и P 0 могут быть выражены в любых, но обязательно одних и тех же единицах — атмосферах, паскалях, миллиметрах ртутного столба (торричелли) и т. д. Однако выражение давления в атмосферах имеет очевидное преимущество, т. к. в этом случае давление и относительное давление численно совпадают 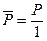 .
.
Таким образом, для 1 моля i - ого компонента газовой смеси мы можем записать:
 (III, 48),
(III, 48),
где 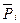 — относительное парциальное давление i - ого компонента.
— относительное парциальное давление i - ого компонента.
Умножив обе части выражения (III, 48) на ni и суммируя по всем индивидуальным веществам в системе, получим:
 (III, 49)
(III, 49)
Подставив значения U, PV и S из уравнений (III, 45), (III, 46) и (III, 49) в выражение для энергии Гиббса, получаем следующий результат:
 (III, 50)
(III, 50)
Первые пять слагаемых в этом уравнении зависят от природы индивидуального i ‑ ого вещества и температуры, но не зависят от состава смеси и давления. Алгебраическую сумму этих пяти слагаемых, стоящих в скобках, обозначим через  . Тогда
. Тогда
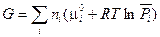 (III, 51)
(III, 51)
или, если ввести обозначение
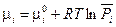 (III, 52)
(III, 52)
то выражение (III, 51) можно окончательно представить в таком виде:
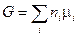 (III, 53)
(III, 53)
Величина 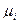 называется химическим потенциалом i - ого вещества, а величина
называется химическим потенциалом i - ого вещества, а величина  — стандартным химическим потенциалом (при
— стандартным химическим потенциалом (при 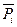 =1) i - ого вещества.
=1) i - ого вещества.
Так как для идеальной газовой смеси 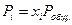 и
и 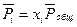 , то уравнение
, то уравнение
(III, 52) можно привести к виду:
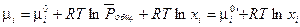 (III, 54)
(III, 54)
где  (III, 55)
(III, 55)
Если  есть функция только температуры, то
есть функция только температуры, то 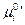 зависит не только от температуры, но и давления.
зависит не только от температуры, но и давления.
Подставив значение m i из уравнения (III, 54) в (III, 53), получим:
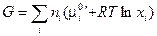 (III, 56)
(III, 56)
Для того, чтобы определить суммарную энергию Гиббса смеси идеальных газов, также следует принять во внимание изменение энергии Гиббса, обусловленное самим процессом смешения:
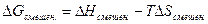
Оно может быть найдено, если принять во внимание, что для идеальных газов 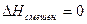 . Ну, а изменение энтропии при смешении нами уже было определено ранее (смотри (II, 26)).
. Ну, а изменение энтропии при смешении нами уже было определено ранее (смотри (II, 26)).
Таким образом,
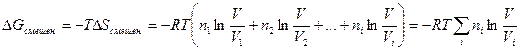
Так как при постоянстве температуры T = const произведение
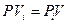 = const, полученное уравнение можно переписать в следующем виде:
= const, полученное уравнение можно переписать в следующем виде:

Принимая во внимание, что Р > 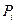 и V >
и V >  , логарифм отношения этих величин — величина положительная, следовательно,
, логарифм отношения этих величин — величина положительная, следовательно,  , что полностью соответствует характеристике самопроизвольно протекающих процессов.
, что полностью соответствует характеристике самопроизвольно протекающих процессов.
Итак, для энергии Гиббса смеси идеальных газов окончательно имеем:

Дата публикования: 2014-11-04; Прочитано: 2377 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
