 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Способы смещения равновесия
|
|
Положение равновесия всегда зависит от внешних условий, а так как внешние условия не могут сохраняться неизменными, то равновесие рано или поздно нарушается (смещается). Влияние изменения внешних условий на положение равновесия - принцип смещения равновесия, или принцип Ле – Шателье: если на систему, находящуюся в устойчивом равновесии, оказать внешнее воздействие, то система отреагирует на это воздействие так чтобы уменьшить его. Влияние давления. Характер влияния давления на равновесие химических реакций определяется знаком разности числа молей газообразных участников реакции 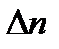 или знаком изменения объема
или знаком изменения объема 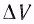
Для газовых реакций, в которых число молей продуктов превышает число молей реагентов, т. е.  , увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей (
, увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей ( ), повышение давления целесообразно — оно смещает равновесие реакции в сторону образования продуктов.
), повышение давления целесообразно — оно смещает равновесие реакции в сторону образования продуктов.
Влияние инертного газа. Введение инертного газа в систему при р =const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей  , разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молей
, разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молей  равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых
равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых  , стремятся к уменьшению накопления инертных газов в системе.
, стремятся к уменьшению накопления инертных газов в системе.
Влияние концентрации. В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья.
Во многих случаях смещение равновесия процесса вправо можно осуществить и выводом продуктов из реакционной зоны — уменьшением концентрации продукта.
Влияние температуры. Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т. е усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление.
Следует отметить, что при изменении температуры равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция.
Итак, применяя принцип Ле Шателье, можно, не производя термодинамических расчетов, предсказать направление химических реакций, т. е. качественно судить о состоянии их равновесия.
Билет №6.
Дата публикования: 2015-11-01; Прочитано: 667 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
