 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методы определения клостридий, протея в мясных продуктах
|
|
Клостридии – споровые палочки, культивируются на 2-ух средах: СЦС(сульфит-циклосерная среда), Вильсона-Блера.
Протекает р-ция с образованием FeS – черная колония.
Разлив пробы в 7 пробирок, из каждого разведения вносится в среду Вильсона-Блера, Т=370С,3 суток. Цвет поменяется-м/о.
На среде Кита-Тароти нужно смотреть за наличием запаха, изменением цвета. Если есть изменение цвета и запаха, то проводится микроскопирование.
Клостридии отличаются способностью расти без доступа О2, формируют эндоспоры, разлагают полисахариды и белки, не требовательны к составу среды. Это те факторы, которые отличают клостридии от др. м/о, и их следует положить в основу элективного метода культивирования. Необходимо приготовить полусинтетическую питательную среду, в которой источником углерода и энергии явл.,напр., крахмал или какой-либо белок. Пробы можно отбирать из богатых органикой почв. После внесения пробы в среду полученную суспензию следует подвергнуть пастеризации, чтобы оставить жизнеспособными одни эндоспоры. Культивирование нужно осуществлять ванаэробных условиях, чтобы исключить доступ О2.
Протеи бывают 2 форм: н-форма (подвижная), о-форма (неподвижная).
Определяют есть подв. форма или нет: скошенный питательный агар, отбирают колонию м/о со среды Энда, и вносят на пит. агар на дно пробирки, ставят на 370, если подв. форма, то она сама начнет ползти. Если нет ползучего налета – м.б. о-форма, а может и не быть протей.
Затем используют среду Плоскарева: засев на сутки, Т=370С. Смотрят образуются колонии. На этой среде растут только патогенные м/о, чаще протеи. Протея образует желтыи колонии, их отбирают и пересеивают на среду Крумвиде-Алькеницкого (здесь добавлена мочевина).Протеи могут активировать мочевину, они выделяют Н2S, не используют лактозу. Колонии меняют цвет на черный =>
25. Характеристика методов посева и культивирования м/о. Периодическое и непрерывное культивирование м/о.
Питательные среды:
- жидкие
- твердые: агаризованные
белковые среды(коллаген, казеин)
1. Посев петлей
В пробирку вносят петлей м/о и ставят в термостат
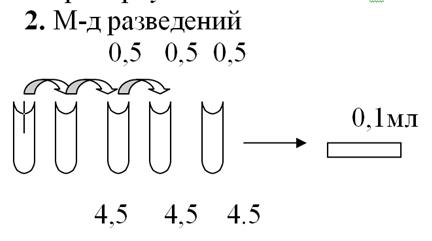
3. М-д наиболее вероятного числа
Используют таблицы
10-2 10-1 100 101 102 103
вероятностные
методы
Чтобы определить вероятность: из нескольких пробирок (100) ч/з определенное время наблюдают помутнение, значит там есть хотя бы одна клетка м/о, которая начала размножаться.
М-ды посева на тв. средах:
1 ) М-д посева уколом: пробирка заливается расплавленным агаром, снимают петлей м/о, прокаливается среда
-м/о могут развиваться на поверхности (аэробы)
-на глубине (анаэробы)
-факультативные аэробы
Если газообразующие, то в агаре будут трещины

3) М-д посева в агар (м-д Коха)
плавят агар (90Сº), охлаждают на водяной бане до 50 Сº, добавляют 1 мл суспензии м/о на чашку и вливают агар (10-12мл), перемешивают пока не застынет агар, ставят в темостат.
4) М-д Дригальского (посев на агар)
В чашку заливают распл.агар и накрывают фильтровальной бумагой, застывает, переварачивают и так хранят. Готовят суспензию м/о путем разведения и из последней отбирается 0,1 мл и наносят ее на чашку, и стерилизованным шпателем разобщают м/о по всей поверхности агара. Разведение надо, чтобы не образовывались ассоциаты.
Число колоний: бактерии-10-300
дрожжи-10-150
плесень- 1-50
Подсчитывают число в противоположных секторах, находят среднее и умножают на 4 и получают число колоний
5) М-д исчерпывающего штриха
Чашка заливается агаром, берут петлю м/о и делают несколько штрихов в одном направлении, петлю стерилизуют и делают штрих
 эти отдельные колонии анализируют, предварительно определяют чистоту м/о
эти отдельные колонии анализируют, предварительно определяют чистоту м/о
Стадии метода посева и культивирования
| Стадии | Жидкие | Твердые |
| 1. Подготовка проб -анализ с поверхности -анализ из глубины 2.Приготовление разведений 3.Посев 4.Культивирование 5.Подсчет м/о | - - + + + +/- | + + + + + + |
Культивирование микроорганизмов сопровождается увеличением их количества и массы и может преследовать разные цели: накопление клеток, обогащение смешанной популяции представителями определенной группы, получение чистой культуры, получение целевого продукта, перевод клеток в нужную фазу роста и др. В результате выращивания микроорганизмов получают их культуру. В зависимости от методов культивирования можно получить чистую и смешанную культуры, культуру клеток в разных фазах роста, синхронизированную и асинхронную, активно метаболизирующую и находящуюся в состоянии анабиоза. С помощью элективных методов культивирования можно выделить из окружающей  среды микроорганизмы определенной группы с желаемыми свойствами.
среды микроорганизмы определенной группы с желаемыми свойствами.
В большинстве случаев культивирование микроорганизмов требует поддержания определенной температуры, поскольку они, как известно, не имеют систем терморегуляции и в высокой степени чувствительны к изменению данного фактора. Культивирование при постоянной температуре называют инкубированием и осуществляют в термостатах. Кроме температуры, при культивировании следует учитывать влияние и других физических и химических факторов на рост микроорганизмов.
При культивировании клеток в жидких средах получают жидкие культуры - суспензии микроорганизмов. О том, что в жидкой среде имеет место рост клеток, можно узнать по культуральным признакам: помутнению среды, появлению пузырьков газа, изменению цвета, формированию на поверхности среды пленки, а на стенках сосуда - пристеночного кольца и т. п. Среди перечисленных признаков наиболее характерным является развитие мутности. Обычно мутность бактериальной суспензии становится визуально различимой, когда концентрация клеток в ней достигает 106 в 1 мл, а дрожжевой - 105 в 1 мл. В жидких культурах таких крупных микроорганизмов, как водоросли и простейшие, концентрация клеток обычно не превышает 103 в 1 мл, и суспензии остаются прозрачными. Однако и в этом случае можно зарегистрировать признаки роста: бесцветные клетки простейших формируют не однородность в суспензии, напоминающую битое стекло, а водоросли обеспечивают изменение цвета суспензии за счет фотосинтезирующих пигментов.
Получение суточной культуры. Инкубирование суточной культуры длится обычно 16-18 ч, захватывая ночное время суток. Эта культура представляет собой суспензию клеток в жидкой питательной среде, в ней достигается максимальная концентрация микроорганизмов и популяция обычно находится в стационарной фазе роста.
Суточная культура очень часто используется при работе с микроорганизмами в качестве стартовой: из нее получают клетки в логарифмической фазе роста, ею инокулируют питательные среды для увеличения объема культуральной жидкости с целью извлечения клеточной массы, эту жидкую культуру удобно использовать для изучения свойств клеток и т. п.
Обычно для аэробных и факультативно анаэробных микроорганизмов суточную культуру получают инокулируя изолированной колонией 2 мл подходящей по составу полноценной жидкой питательной среды. Обязательным условием получения суточной культуры является подготовка контроля за соблюдением правил асептики. Поступают следующим образом. В две стерильные пробирки вносят одной и той жестерильной пипеткой по 2 мл полноценной питательной среды. Пробирки маркируют. Затем в одну из них (опытную) петлей засевают изолированную колонию микроорганизма. Помещают посевы в термостат и инкубируют 16-18 ч. Перед использованием суточной культуры следует убедиться, что среда в контрольной пробирке осталась прозрачной и не имеет иных признаков роста микроорганизмов. В противном случае приходится констатировать, что условия асептики не были соблюдены ив опытной суспензии содержатся посторонние микроорганизмы, то есть использовать такую культуру нельзя!
Получение культур в логарифмической фазе роста. Часто для проведения экспериментов с микроорганизмами требуется получить клетки в фазе физиологической молодости, которые демонстрируют наибольшую физиологическую активность, отличаются стандартизированными параметрами, наиболее чувствительны к факторам окружающей среды. Известно, что такие клетки составляют популяцию, пребывающую в логарифмической фазе роста. Чтобы обеспечить переход популяции в данную фазу, необходимо создать наиболее благоприятные условия культивирования для микроорганизмов. Например, по отношению к бактериям Е. соli следует поступить следующим образом. Необходимо суточную культуру этих бактерий (в ней клетки находятся в стационарной фазе роста) развести питательным бульоном, чтобы обеспечить клетки питательными веществами, уменьшить их численность и концентрацию продуктов метаболизма. Обычно разводят суточные культуры в 10-100 раз. Поскольку известно, что данные бактерии более энергично растут в условиях аэрации, следует поместить суспензию в плоскодонную колбу, заняв небольшую часть ее объема и культивировать в термостатированной роторной качалке при 37Сº. Для достижения популяцией бактерий кишечной палочки средней логарифмической стадии роста бывает достаточно 3-4ч.
Методы периодического и непрерывного культивирования
Культивирование микроорганизмов в жидкой среде можно осуществлять в закрытой системе (пробирка, колба, ферментер), где постоянно изменяются условия и культура проходит несколько фаз роста, а также в открытой системе, которая позволяет производить обмен среды. Первый способ культивирования называется периодическим. Он позволяет поддерживать размножение клеток только в течение ограниченного времени — на протяжении экспоненциальной фазы роста.
Открытая система обеспечивает непрерывное (проточное) культивирование, при котором рост клеток происходит постоянно, в течение всего времени культивирования. Если скорость подачи свежей среды уравновешивает скорость отбора культуральной жидкости (а вместе с ней продуктов метаболизма и части клеток) и суспензия хорошо перемешивается, то рост популяции поддерживается на одной и той же стадии логарифмической фазы роста. Такая система называется равновесной. В ней достигается состояние динамического равновесия между двумя экспоненциальными процессами: удельной скоростью роста культуры и. и скоростью вымывания клеток из сосуда D, которая определяется отношением скорости подачи среды в сосуд F к объему жидкости в нем V:
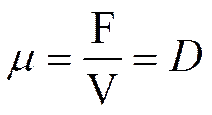
Существуют два основных, принципиально различающихся, способа непрерывного культивирования, подчиняющихся автоматическому регулированию: с использованием хемостата и турбидостата.
Хемостат. В этом устройстве состояние равновесия достигается путем регулирования скорости роста концентраций поступающих субстратов. В основу работы хемостата положена следующая закономерность: скорость роста логарифмической культуры в любой момент времени определяется концентрацией одного какого-либо субстрата. Зависимость скорости роста от концентрации субстрата описывается кривой насыщения и выражается уравнением Моно (рис. 87).

Рис. 87. Зависимость скорости роста культуры (μ) от концентрации субстрата (S), где Кs— константа насыщения для субстрата (концентрация лимитирующего вещества при скорости роста, достигающей половины максимального значения (μ мах/2)
Стабильность динамического равновесия культуры в хемостате обусловлена тем, что ее рост лимитирует концентрация какого-либо субстрата (источника углерода, азота, серы или фосфора, донора или акцептора электронов). Скорость роста поддерживается на низком уровне. В этом случае реактор приобретает свойства саморегулирующейся системы: как только скорость разбавления и вымывания клеток становится выше скорости их роста, увеличивается концентрация лимитирующего фактора, что влечет за собой увеличение скорости роста. И наоборот: если μ превышает D, концентрация лимитирующего фактора уменьшается, а вместе с ней уменьшается и скорость роста.
Хемостат состоит из сосуда-культиватора, снабженного перемешивающим устройством и системой подачи кислорода, а также двумя выводными отверстиями. Через одно из них подается свежая питательная среда, а через другое отводится культуральная жидкость.
Турбидостат. Представляет собой похожее на хемостат устройство, в котором, однако, состояние равновесия достигается путем удаления биомассы и замещения ее свежей средой со скоростью, приближающейся к максимальной скорости роста культуры. В сосуде-культиваторе все питательные вещества содержатся в избытке, а плотность клеток поддерживается на постоянном уровне с помощью фотоэлектрических датчиков. Сигнал от датчика управляет скоростью протока жидкости.
Дата публикования: 2015-11-01; Прочитано: 1832 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
