 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Термодинамика открытых систем
|
|
Живые системы являются открытыми и поэтому относятся к неравновесным. Такая термодинамически открытая система характеризуется тем, что в ней постоянно протекают химические реакции. Биохимические реакции на всех стадиях являются каталитическими. Катализаторами в этих реакциях являются белки-ферменты.
Изменение энтропии такой системы определяется как сумма энтропии, производимой внутри системы diS, и энтропии, поступающей извне или выделяющейся во внешнюю среду deS.
dS = diS + deS (20.1)
Величина diS всегда положительна (второе начало термодинамики). Если систему изолировать, то deS = 0. Тогда dS будет постоянно увеличи-ваться. Знак deS зависит от направления процесса. diS – изменение (произ-водство) энтропии в результате внутренних химических реакций. Уравнение (20.1) характеризует стационарный, но неравновесный процесс открытой системы. В стационарном состоянии dS = 0, или deS = – diS < 0, то есть производимая энтропия полностью уходит во внешнюю среду.
Живой организм получает из внешней среды пищу, кислород, воду и выделяет в нее различные вещества. Между организмом и средой осуществляется теплообмен. В таких условиях находится космонавт в космическом корабле. Организм космонавта – открытая система по отношению к кораблю. В то же время сам корабль хорошо изолирован от внешней среды.
Общее изменение энтропии всей системы положительно (второе начало термодинамики).
dS = dS1 + dS2 >0,
где dS1 и dS2 - изменение энтропии космонавта и окружающей среды.
dS1 = diS1 + deS1.
Изменение энтропии dS2 происходит в результате обмена между окружающей средой и космонавтом (массо- и теплообмен). Производства энтропии в среде, окружающей космонавта, практически нет. Тогда
dS2 = – deS1 и dS = diS1 >0.
Если состояние космонавта стационарно, то
dS1 = 0, deS1= – diS1<0, dS2 = dS = diS1 >0.
Таким образом, стационарное состояние космонавта поддерживает-ся возрастанием энтропии в окружающей среде, определяемым оттоком в ней энтропии из организма космонавта, компенсирующим продукцию энтропии в его организме. Энтропия среды возрастает dS2 >0 за счет выделения тепла космонавтом, и вследствие того, что энтропия веществ, выделяемых космонавтом, выше энтропии потребляемых им веществ.
Стационарное состояние может быть длительным, но не вечным: либо исчерпаются запасы окружающей среды, либо произойдет старение организма. Первое состояние достигается по быстрой временной шкале, второе – по медленной.
Примером может служить система, состоящая из двух резервуаров, имеющих разные температуры. Резервуары соединены между собой тонким теплопроводом. В проводнике устанавливается постоянный ток тепла. Любой отрезок проводника находится в стационарном состоянии, которое сохраняется, пока не изменится температура в первом и во втором резервуарах. Температуры в них будут медленно выравниваться. Время установления стационарного состояния меньше времени достижения полного равновесия, в котором температуры уравнены. Обычно в практических расчетах температуры первого и второго резервуаров принимаются постоянными.
Существование биосферы можно рассматривать как стационарный процесс, реализуемый в условиях необратимого процесса охлаждения Солнца.
21. Механохимические процессы
21.1. Термодинамика механохимических процессов
Жизнь сопровождается движением. Клетки и организмы выполняют механохимическую работу. Они могут передвигаться как целое, а также перемещать свои функциональные части в поле тяготения, преодолевая сопротивление среды. Механическая работа совершается при Т = const. и P = const. не за счет тепловой, а за счет химической энергии.
В любой химической реакции происходит перемещение атомов (ионов), но это не значит, что имеет место механохимический процесс. Говоря о механохимическом процессе, имеют в виду макроскопическую систему на надмолекулярном уровне.
Рабочим веществом в механохимических процессах живых организмов могут быть белки – ферменты. Механохимия живых систем есть ферментативная механохимия.
Механохимическая работа в живом организме происходит циклически. Моделью такого процесса может служить волокно сделанное из полиэлектролита. Длина такого волокна меняется при воздействии внешней Среды, например, с изменением рН среды. Изменение внутренней энергии системы определяется:
dE=TdS - dW -  m idni +Y de +.
m idni +Y de +.
dW – работа, производимая системой, dni – количество вещества i с хими-ческим потенциалом m i, Yde – электрическая работа.
Если ограничиться термическими, механическими и химическими процессами и не принимать во внимание электрической работы и других составляющих, то, если волокно длиной l растягивается силой f уравнение примет вид
dE= TdS – pdV +fdl + Sm idni.
После интегрирования
E= TS – pV +fl + Sm i ni + mq nq,
где nq – число молекул образующих волокно.
Если имеется только одна реагирующая компонента, то при р = const и Т = const система имеет две степени свободы, например f и m.
Изобразим рабочий цикл механохимической машины в координатах f-l, как показано на рис.45.
Каждому значению m соответствует кривая l(f), которую принято называть изопотенциалом (по аналогии с изотермой в координатах p-V для теплового двигателя).
 m n1 n2
m1
m2
n m n1 n2
m1
m2
n
| f n1 n2 m1 m2 l |
| Рис.45. Рабочий цикл механохимической машины |
Кривая l(f) при n = const подобна адиабате. Она называется изофо-рой. В координатах m-n изопотенциалы и изофоры представляют собой прямые, параллельные осям координат.
Кривые m (n) на этой плоскости можно назвать изотоническими при f = const и изометрическими при l = const.
Цикл в координатах f-l выглядит как цикл Карно.
Работа будет определяться
W = – 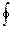 fdl= ò mdn +ò m dn =(m1 – m2)D n.
fdl= ò mdn +ò m dn =(m1 – m2)D n.
Для цикла Карно
W = 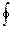 рdV =(T 1 – T2)D S.
рdV =(T 1 – T2)D S.
Отличие состоит в том, что механохимическая машина не допускает характеристики КПД = (T1 – T2)/T1, как в тепловой машине, поскольку химический потенциал не характеризуется абсолютным нулем.
КПД механохимического процесса определяется отношением работы в реальном цикле к работе идеального обратимого цикла:
КПД = – ò fdl/ ò mdn.
Дата публикования: 2015-11-01; Прочитано: 2870 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
