 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Адгезионная функция
|
|
Введение
Бета-катенин — белок, находящийся в комплексе с кадгеринами — молекулами клеточной адгезии в клетках животных. Первые два изученные вида катенина получили названия α-катенин и β-катенин. Также были открыты вспомогательные γ-катенин и δ-катенин. Название белка произошло от латинского «катена» — цепь (лат. 'catena'), так как считалось, что катенин прикрепляет кадгерин кцитоскелету.
В геноме человека белок бета-катетин закодирован геном CTNNB1. Молекулярная масса 80 кД.
Обнаружение гомологии бета-катенина и с белком, продуктом гена сегментной полярности у Drosophila Armadillo (Arm), который является компонентом wnt/wingless сигнального пути, контролирующего процессы эмбриогенез а, позволило предположить, что эти адгезионные белки также вовлечены в сходные сигнальные процессы у позвоночных [1]. Кроме того, как бета-катенин в культивируемых мышиных клетках, так и Arm из Drosophila аккумулируются в цитоплазме при активации wnt/wingless сигнала [2] и оба белка на определенных стадиях развития обнаруживаются в ядре.
С каждым годом появляется все больше данных о том, что адгезионная и транскрипционная функции бета-катенина тесно связаны между собой и вовлечены в изменения морфологии и подвижности опухолевых клеток [ 3:102, 820-828;4: 16, 51-59 ].
Целью данного реферата является обобщить имеющуюся на сегодняшний день информацию о белке бета-катенине, привести необходимые схемы и иллюстрированный материал, также сведения о результатах различных исследований его функций в норме и при патологии, в частности его роль в канцерогенезе, и возможностях их применения.
Адгезионная функция
Катенины альфа, бета и гамма присутствуют в бляшке межклеточных адгезионных контактов, а именно адгезионных поясков.
Адгезионные пояски (zonula adhаerens)— контакт окружает по периметру всю клетку в виде пояса, располагается в верхних отделах боковых поверхностей эпителиальных клеток.
Адгезионные пояски – это динамичные, реагирующие на вне- и внутриклеточные условия структуры, играющие важную роль вморфогенезе, регуляции клеточного размножения, дифференцировке.
Структурно адгезионные контакты содержат три домена:
1) трансмембранный домен, содержащий адгезионные молекулы;
2) цитоплазматическая бляшка, расположенная с цитоплазматической стороны мембраны;
3) цитоскелетный домен, содержащий прикрепленные к бляшке актиновые филаменты и ассоциированные с ними белки.
В состав адгезионных контактов входит большое количество белков, часть из которых является общими для всех типов адгезионных контактов, а часть характерна лишь для межклеточных контактов или для контактов с матриксом. Некоторые из контактных белков имеют тканеспецифическое распределение.
Адгезионные пояса соседних клеток находятся друг напротив друга, и взаимодействующие плазматические мембраны удерживаются вместе трансмембранными линкерными белками - членами семействакальций-зависимых молекул межклеточной адгезии - кадхеринов.
Клетки позвоночных экспрессируют один или более типов кадхеринов, каждый из которых кодируется отдельным геном; для определенного типа клеток характерен определенный набор экспрессируемых кадхеринов; и на данный момент известно около дюжины типов кадхеринов. Кадхерины одной клетки связываются с кадхеринами того же типа соседней клетки (гомофильный механизм). Большинство кадхеринов представляют собой единожды пересекающие плазматическую мембрану гликопротеины (700-750 аминокислот).
Молекула кадхерина, встроенная в плазматическую мембрану, имеет внеклеточную, трансмембранную и внутриклеточную области. Внеклеточная область классических кадхеринов состоит из пяти доменов (ЕС1-ЕС5), каждый из которых образован 110 аминокислотами. Часть внеклеточных доменов гомологична. Между доменами имеются четыре Са2+-связывающих сайта. В отсутствие кальция кадхерины претерпевают большую конформационную перестройку и, в результате, быстро деградируются протеазами. Цитоплазматический домен кадхеринов высококонсервативен и включает в себя прилежащий к мембране сайт, связывающий кадхерин с p120-катенином (pi 20), и С-концевой сайт связывания с бета-катенином, регулирующими межклеточную адгезию [5: 5, 614-625 ]. Кадхерины через бета-катенин, плакоглобин, альфа-катенин связываются с актиновыми филаментами, которые стабилизируют их структуру [6: 9, 317-321; 7: 92,8813-8817 ]. Взаимодействие Е-кадхерин-бета-катенин-альфа-катенин-актиновые филаменты в области межклеточных контактов носит динамический характер [8: 123,903-915, 889-901].
Кадгерины изначально синтезируются в виде предшественников, которые претерпевают несколько посттрансляционных модификаций, включая протеолитическое расщепление. Правильное расщепление предшественников необходимо для построения адгезивных димеров - адгезионные свойства они приобретают только после процессинга белка. С предшественником кадгерина в эндоплазматическом ретикулуме первым связывается катенин-бета, а катенин-альфа и катенин-гамма присоединяются к комплексу позже, во время процессинга молекулы.
Регулируемая экспрессия кадхеринов и катенинов играет важную роль в морфогенезе, контролируя мобильность клеток и формирование клеточных пластов в эмбриогенезе и при регенерации. Посттрансляционная регуляция Е-кадхерин-катенинового комплекса обеспечивается фосфорилированием по тирозину бета-катенина. Такое фосфорилирование осуществляется благодаря активации подмембранной тирозиновой протеинкиназы src (pp60src) или задействования трансмембранных рецепторов факторов роста - EGF, PDGF или " рассеивающего фактора ". Предполагается, что в передаче сигнала от подмембранной протеинкиназы src и от EGF- или PDGF-рецепторов главную роль играет прямо связанный с цитоплазматическим доменом Е-кадхерина белок р120cas, являющийся субстратом для протеинкиназы src [ Vermeulen, S. et al. (1996), Hinck, L. et al. (1994), Mareci, M. et al. (1996) ]. Изменения в фосфорилировании бета-катенина приводят к снижению функции Е-кадхерин-катенинового комплекса (возможно, из-за нарушения взаимодействия кадхерина с другими белками контакта и с цитоскелетом) и к ослаблению межклеточной адгезии.
Стойкая дестабилизация межклеточных контактов является основой инвазии и метастазирования. Дестабилизация кадхерин-опосредованных контактов может быть обусловлена действием онкогенов, таких как src, erbB или met, продукты которых, обладая протеинкиназной активностью, вызывают гиперфосфорилирование бета-катенина [ Vermeulen, S. et al. (1996) ].
Е-кадхерин (иначе увоморулин) обычно обнаруживается в адгезионных поясах зрелых эпителиальных клеток, где он объединяеткортикальные актиновые цитоскелеты тех клеток, которые он удерживает вместе. Е-кадхерин также является первым кадхерином, экспрессируемым в ходе эмбрионального развития: Е-кадхерин участвует в важном морфологическом процессе - компактизации, происходящей на восьмиклеточной стадии развития млекопитающих. Во время компактизации слабо связанные бластомеры плотно упаковываются и соединяются межклеточными контактами.
Кадхерины играют также центральные роли и на более поздних стадиях развития, так как их исчезновение и появление коррелирует с основными морфологическими событиями, в ходе которых ткани отделяются одна от другой. В ходе формирования нервной трубкии ее отделения от вышележащей эктодермы клетки нервной трубки теряют Е-кадхерин и приобретают N- кадхерин, в то время как клетки вышележащей эктодермы продолжают экспрессировать Е-кадхерин.
Потеря Е-кадхерина или других компонентов системы способствует прогрессии опухоли и метастазированию [ Vleminckx K. et al., 1999, Perl A.K. et al., 1998 ].
Е-кадхерин супрессирует способность к инвазии и метастазированию в эпителиальных опухолевых клетках (Birchmeier W, Behrens J., 1994; Takeichi M., 1993).
Утрата экспрессии и фукции Е-кадхерина приводит к увеличению инвазивности клеток в культуре, кроме того, недостаток или мутации Е-кадхерина коррелируют со способностью к инвазии и метастазированию в некоторых человеческих опухолях. Нокаут гена Е-кадхерина у мышей оказываются летальными на очень ранних стадиях развития, что безусловно затрудняет исследование его роли как опухолевого супрессора, но показывает, насколько важен этот белок для развития организма (Laure L. et al., 1994).
Комплекс Е-кадхерин-бета-катенин формируется в эндоплазматическом ретикулуме, после чего транспортируется на плазматическую мембрану [ Chen (1999) ]. При образовании адгезионных контактов (АК) бета-катенин обеспечивает связь между кадхерином и альфа-катенином и играет важную роль в поддержании стабильности контактов [ Kemler (1993) ]. Тирозинфосфатаза PTP1B.i, входящая в состав адгезионных комплексов, поддерживает бета-катенин в дефосфорилированном состоянии [ Lilien (2005) ]. Нарушение адгезионной функции бета-катенина связано в первую очередь с фосфорилированием по тирозину в 142-м и 654-м положениях, что приводит к разборке Е-кадхеринсодержащих комплексов в мембране. Фосфорилирование бета-катенина по Tyr654, осуществляемое c-src, нарушает его связывание с Е- кадхерином и разрушает межклеточную адгезию [ Roura (1999), Piedra (2003) ].
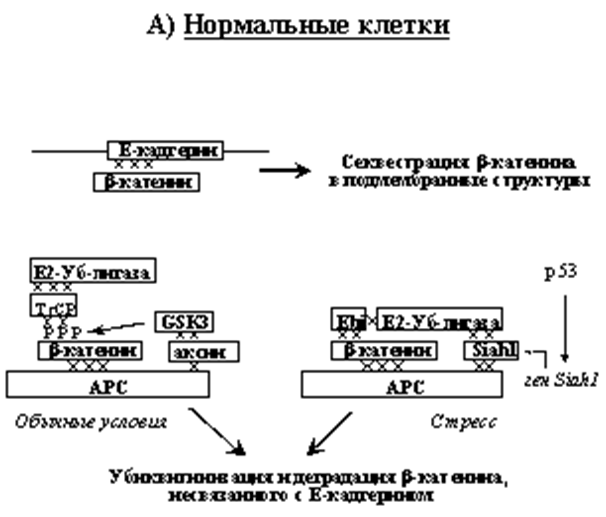
В несвязанном с Е-кадгерином состоянии β-катенин очень нестабилен. Ключевую роль в регуляции его времени жизни и транскрипционной активности играет «деструктирующий комплекс», содержащий белок супрессор опухолей- adenomatous polyposis coli (APC), цитоплазматический «поддерживающий» белок Axin, а также протеинкиназу GSK-3 (glycogen synthase kinase 3 beta) и казеин киназу (CK1). АРС связывает одновременно и b-катенин и аксин (рис. 1), в результате чего образуется сложный комплекс, к которому рекрутируется GSK-3b (киназа-3b гликогенсинтетазы). Фосфорилируя определенные сериновые остатки β-катенина на N- конце (где содержится около 130 аминокислот), GSK-3b индуцирует связывание его с Е2-убиквитин-лигазой. Убиквитинированный b-катенин направляется в протеосомы, где происходит его деградация. При стрессах, вызывающих активацию р53, включается дополнительный механизм деградации β-катенина (Рис. 1). В этом случае происходит повышение экспрессии белка Siah1, который рекрутирует другой тип комплексов Е2-убиквитин-лигазы также и к нефосфорилированному по N-концу b-катенину. Таким образом достигается, по-видимому, более эффективная деградация несвязанного с кадгеринами β-катенина.
Дата публикования: 2015-11-01; Прочитано: 920 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
