 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Молекулалық физика және термодинамика бойынша есептер шығару әдістері
|
|
Молекулалық физика макроскопиялық жүйелердiң физикалық қасиеттерiн зерттейдi. Макроскопиялық жүйеге газдар, сұйықтар, қатты денелер және плазма жатады. Әртүрлi физикалық қасиеттерi бар бұл заттардың зерттеуге мүмкiндiк беретiн жалпы ортақ белгiсi, олар өте ұсақ бөлшектерден: молекулалардан, атомдардан және электрондардан тұрады.
Молекула - заттың барлық химиялық қасиеттерiн сақтай алатын өте кiшкене бөлшегi. Молекулалардың өзi қарапайым бөлшектер - атомдардан тұрады. Атом ядросы екi түрлi бөлшектерден тұрады: заряды сан жағынан электрон зарядымен бiрдей оң зарядталған протоннан, зарядсыз нейтроннан. Ол бөлшектер жалпы нуклондар деп аталады. Ядро бөлшектерi тартылыс күшi — ядролық күшпен байланысқан.
Заттың күйiн анықтайтын физикалық шамаларды параметрлер деп атайды. Газ массасының күйi P — қысым, V — көлем, T — температура мәндерi арқылы анықталады. Бұл параметрдiң байланысы аналитикалық түрде берiледi.
F(P,V,T)=0 (1)
Қандай да бiр дененiң параметрлерiнiң арасындағы байланысты беретiн теңдеу осы дененiң күй теңдеуi деп аталады. Демек, (1) газдың берiлген массасының күй теңдеуi болып табылады. Егер де (1) теңдеуiн қандай да бiр параметрге, мысалы P -ға қатысты шешетiн болсақ, онда күй теңдеуi P=f(V,T) түрiнде жазылады.
Молекулалық-кинетикалық теорияның негiзгi қағидалары. Молекулалық-кинетикалық теорияның бiрiншi қағидасы: молекулалар тәртiпсiз, хаосты, жылулық қозғалыста болады да, кеңiстiктiң барлық бағытындағы қозғалыс ықтималдылығы бiрдей болады.
Екiншi қағида: молекулалардың орташа квадраттық жылдымдығы абсолют температураның квадраттық түбiрiне тура пропорционал  .
.
Үшiншi қағида: температуралары бiрдей әртүрлi газдардың молекулалардың орташа кинетикалық энергиялары өзара тең, яғни:
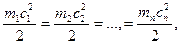 (2)
(2)
мұндағы 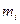 — молекулалардың массасы,
— молекулалардың массасы,  — орташа квадраттық жылдамдықтар. Бұл қағида барлық газдар үшiн бiрдей.
— орташа квадраттық жылдамдықтар. Бұл қағида барлық газдар үшiн бiрдей.
Заттың бiр мольге тең мөлшерiнде  молекулалар саны болады. Бұл бөлшектер бiр-бiрiне қатынасты тынымсыз қозғалыста және олардың арасында күрделi әсерлесулер өтiп жатады. Мұндай кездейсоқ өзгерiстер, құбылыстар ықтималдылықтар iлiмiнде қарастырылып негiзделедi. Бұл iлiмге қатынасты математикалық негiзгi тұжырымдарды негiзiнен идеал газға қатысты қарастырамыз.
молекулалар саны болады. Бұл бөлшектер бiр-бiрiне қатынасты тынымсыз қозғалыста және олардың арасында күрделi әсерлесулер өтiп жатады. Мұндай кездейсоқ өзгерiстер, құбылыстар ықтималдылықтар iлiмiнде қарастырылып негiзделедi. Бұл iлiмге қатынасты математикалық негiзгi тұжырымдарды негiзiнен идеал газға қатысты қарастырамыз.
Газдың кинетикалық теориясының негiзгi теңдеуi. Газдардың кинетикалық теориясының негiзгi теңдеуi молекулалық-кинетикалық теорияда ерекше орын алады. Бұл теңдеудiң көмегiмен газ заңдарын, молекулалардың энергиясы, температурасының қатынасын т.б. анықтауға болады. Молекулалардың өзара соқтығысуы олардың жылдамдық және энергия бойынша таралуын тудырады да, ыдыс қабырғасына түсiретiн қысымына әсер етпейдi.
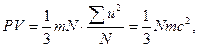 (4)
(4)
мұндағы c — молекуланың орташа квадраттық жылдамдығы.
(3) теңдеу газдардың кинетикалық теориясының негiзгi теңдеуi деп аталады: газ қысымының көлемiне көбейтiндiсi молекулалар саны мен массасының орташа квадраттық жылдамдығының көбейтiндiлерiнiң үштен бiрiне тең. Бұл теңдеудi түрлендiрiп былай жазуға болады:

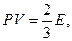 (5)
(5)
мұндағы E=Nε — молекулалардың iлгерiлемелi қозғалысының кинетикалық энергиясы. Сонымен, газ қысымының көлемiне көбейтiндiсi молекулалардың iлгерiлемелi қозғалысының кинетикалық энергиясының екiден үш бөлiгiне тең.
Газдың кинетикалық теориясының негiзгi теңдеуiнен идеал газ заңдарын шығаруға болады. Бойль-Мариотт заңы: Газдың берiлген массасы үшiн оның қысымының көлемге көбейтiндiсi берiлген температурада тұрақты шама. Бұл тұжырымдаманы Бойль-Мариотт заңы дейдi, ал тұрақты температурадағы процестi изотермалық процесс деп атайды.
PV = тұрақты. (6)
Гей-Люссак заңы: Тұрақты қысымда газдың берiлген массасы көлемiнiң температураға сызықтық байланыстылығын көрсетедi.
 αtº) (7)
αtº) (7)
Бұл теңдеулер tºC — Цельсии шкаласы бойынша алынған,  - 0º кезiндегi көлем,
- 0º кезiндегi көлем,  - 0ºС кезiндегi қысым α коэффициентi 1/273.15 шамасына тең. Тұрақты қысым кезiнде өтетiн процесс изобаралық процесс деп аталады.
- 0ºС кезiндегi қысым α коэффициентi 1/273.15 шамасына тең. Тұрақты қысым кезiнде өтетiн процесс изобаралық процесс деп аталады.
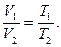 (7/)
(7/)
Қысым тұрақты болғанда газдың көлемi абсолют температураға тура пропорционал, бұл заңдылықты Гей-Люссак заңы дейдi.
Шарль заңы: Тұрақты көлемде өтетiн процесс изохоралық процесс деп аталады. 0К-ге тең температура абсолют ноль деп аталады, оған — 273,15 К мәнi сәйкес келедi.
P=αP  T (8)
T (8)
Соңғы теңдеуден:
 (V=тұрақты) (8/)
(V=тұрақты) (8/)
екендiгi шығады.
Идеал газдардың универсалды теңдеуi. Газ күйiнiң негiзгi параметрлерiн байланыстыратын теңдеудi газ күйiнiң теңдеуi деп атайды. Газ күйiнiң негiзгi парметрлерi болып қөлем, қысым және температура есептеледi. Идеал газ күйiнiң универсалды теңдеуi немесе Клапейрон-Менделеев теңдеуi газ күйiнiң бiрiккен заңынан табылады. Бiрiктiрiлген заң газдың кез келген күйi үшiн, сонымен бiрге температурасы 0ºC -де, қысымы бiр атмосфера көлемдегi газ үшiн де дұрыс. Газдың бұл күйiн қалыпты жағдайдағы күйi деп атайды.
 (9)
(9)
Кез келген 1 моль газдың 0ºС температурада және атмосфералық қысымдағы көлемi 22,41 литрге тең. Олай болса, теңдеудiң оң жақ бөлiгi барлық газдар үшiн тұрақты шама. Бұл универсалды газ тұрақтысы R әрпiмен белгiленедi де, (9) теңдеуi мына түрде жазылады:
PV=RT. (10)
Молекулалық массасы μ -ге тең кез келген газдың m массасын қарастыратын болсақ, онда моль саны 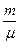 -ге тең болады да, Клапейрон-Менделеев теңдеуi мына түрде жазылады:
-ге тең болады да, Клапейрон-Менделеев теңдеуi мына түрде жазылады:
PV= 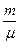 RT (10/)
RT (10/)
Газдың бiр молiнiң қалыпты жағдайлардағы көлемi 22,4 л/моль. Газдың универсал тұрақтысының мәнi мына түрде анықталады:
R=8,31·10 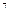
 =0,0820
=0,0820 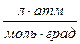 =8,31·10
=8,31·10 

Идеал газдың универсалды күй теңдеуiнен Бойль-Мариот, Гей-Люссак, Шарль заңдарын шығарып алуға болады. Идеал газдың температурасы, оның басқа параметрлерiнiң арасындағы қарапайым байланыс оны термометриялық шама есебiнде пайдалануға мүмкiндiк бередi.
Молекуланың кинетикалық энергиясы. Больцман тұрақтысы. Молекуланың iлгерiлемелi қозғалысының кинетикалық энергиясы:
ε 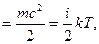 (11)
(11)
мұндағы i — молекуланың еркiндiк дәрежесiнiң саны, c — молекуланың орташа квадраттық жылдамдығы.
Газ молекулаларының санын N десек, iшкi энергиясы:
U=  NkT. (12)
NkT. (12)
Бiр моль газ үшiн:
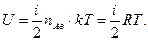 (12/)
(12/)
Осы энергияны 1 моль идеал газдың iшкi энергиясы деп атайды. Энергия бiрлiгi мен температура бiрлiгi — Кельвин арасындағы қатынасты өрнектейтiн k көбейткiшi — Больцман тұрақтысы деп аталады. Оның сандық мәнi СИ бiрлiктер жүйесiнде:
k=1.380662· 10  Дж/К мынаған тең.
Дж/К мынаған тең.
1К температураға 1.38· 10  Дж энергия сәйкес келеді.
Дж энергия сәйкес келеді.
Термодинамика денелердiң әртүрлi қасиеттерiн және зат күйiнiң өзгерiстерiн зерттейді. Термодинамика денелер мен табиғат құбылыстарының тек макроскопиялық қасиеттерiн зерттейдi. Термодинамика — жылулық қозғалыстың, жүйенiң физикалық қасиеттерiне тигiзетiн ықпалын энергетикалық тұрғыдан қарастыратын ғылым.
Термодинамикалық зерттеу термодинамиканың екi заңына (бастамасына) негiзделген. Термодинамиканың 1-шi бастамасы жүйедегі физикалық құбылыстарды энергияның сақталу заңы тұрғысынан қарастырады, ал 2-шi бастамасы табиғатта, денелерде болатын өзгерiстер мен құбылыстардың қай бағытта өздiгiнен жүретiндiгiн көрсетедi.
Термодинамиканың бiрiншi бастамасы. Ішкi энергия негiзiнен екi түрлi процестiң: дененiң жұмыс iстеуiмен, денеге берiлген жылу мөлшерiнiң есебiнен өзгередi. Жұмыс жүйеге әсер етушi сыртқы денелердiң орын ауыстыруымен байланысты. термодинамикалық жүйеге сырттан берiлген жылу оның iшкi энергиясын арттыруға және жүйеге әсер ететiн сыртқы күшке қарсы жұмыс iстеуге жұмсалады. Математикалық түрде былай жазылады:
δQ=dU+ δA. (13)
Мұнда δQ — жүйеге сырттан берiлген жылу; dU — iшкi энергия өзгерiсi; δA — термодинамикалық жұмыс. Термодинамиканың 1-шi заңын жылу құбылыстары үшiн энергияның сақталу заңы деп атайды.
Термодинамиканың екінші бастамасы. Табиғаттағы нақты процестердің бағытын термодинамиканың екінші бастамасы анықтайды. Термодинамиканың 2-шi заңы жұмыс пен жылудың бір-біріне эквивалентті шамалар болғанмен, олардың сапа жағынан тең еместігін көрсетеді. Басқаша айтқанда, жұмыс өздігінен әруақытта жылуға айнала алады, ал жылу сыртқы әсерсіз өздігінен жұмысқа айналмайды. Термодинамиканың екінші бастамасы статистикалық заң болғандықтан, жүйенің термодинамикалық тепе-теңдіктен ығысуы, яғни флуктуациясы заңдылық деп түсінеді.
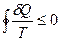 (14)
(14)
(14) теңдеу термодинамиканың. II заңының математикалық өрнегі болып табылады да Клаузиус теңсіздігі деп аталады.
Сұйықтардың беттiк керiлу коэффициентi олардың табиғатына байланысты қатты өзгередi. Мысалға судың σ = 73· 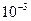 Н/м; сабынды қоспаның σ= 45·
Н/м; сабынды қоспаның σ= 45· 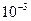 Н/м; эфирдiкi σ = 23·
Н/м; эфирдiкi σ = 23· 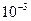 Н/м; ерiтiндi тұздар үшiн ~100·
Н/м; ерiтiндi тұздар үшiн ~100· 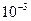 , Н/м; балқыған металдардың ~1.0; балқытылған платинаның ~17·
, Н/м; балқыған металдардың ~1.0; балқытылған платинаның ~17· 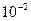 Н/м. Сұйытылған газдардың беттiк керiлу коэффициентi төмен.
Н/м. Сұйытылған газдардың беттiк керiлу коэффициентi төмен.
Мысал 1. Көлемі 20 л ыдыстың ішінде 270С температурадағы 4 г сутегі бар. Сутегінің қысымын табу керек.
Шешуі: Идеал газдар газдың V көлемін, оның р қысымын Т абсолют температурасын және m массасын байланыстыратын Менделеев–Клапейрон теңдеуіне бағынады:
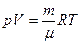 (1)
(1)
(1) теңдеудегі R – СИ бірлігіндегі 8,31.103 Дж/кмоль.град -қа тең газ тұрақтысы;  – бір киломольдің массасы;
– бір киломольдің массасы;  – киломольдің саны.
– киломольдің саны.
(1) теңдеуден мынаны аламыз:
 (2)
(2)
Бізде  ,
,  ,
,  ,
,  . Осы берілгендерді (2)-ге қойып, қысымды табамыз:
. Осы берілгендерді (2)-ге қойып, қысымды табамыз:

Мысал 2. Көлемі 1 л ыдыста 27 0С температурада қысымы 10-6 мм сын. бағ. азот бар. Азот молекуласының санын анықтау керек.
Берілгені: V=1 л= 10-3м3; Т=270С+2730С=300 К; р=10-6 мм с. б.=133,3.10-6Па
Табу керек:N–?
Шешуі: Газдың бірлік көлеміндегі молекулалар саны мына формула бойынша есептеледі:
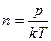 ;
;
Ал ыдыс ішіндегі молекулалар саны:  ;
;
Больцман тұрақтысы саны  ескеріп, молекулалар санын табамыз. Сонда
ескеріп, молекулалар санын табамыз. Сонда

Мысал 3. Массасы 160г оттегі тұрақты қысымда температурасы 320 К-нен 340 К-ге дейін қыздырылады. Қыздыруға кеткен жылу мөлшерін  , ішкі энергияның өзгерісін
, ішкі энергияның өзгерісін 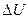 және газдың ұлғаю кезіндегі жұмысын
және газдың ұлғаю кезіндегі жұмысын 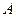 табу керек.
табу керек.
Берілгені: 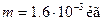 ;
;  =320K;
=320K;  =340K.
=340K.
Табу керек:  –?
–? 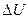 –?
–? 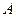 –?
–?
Шешуі: Газды қыздыру үшін қажетті жылу мөлшері (тұрақты қысымда):

Мұндағы:  және
және  тұрақты қысымдағы газдың меншікті және молярлық жылу сыйымдылықтары:
тұрақты қысымдағы газдың меншікті және молярлық жылу сыйымдылықтары:
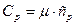
Екі атомды газдар үшін:  . Олай болса:
. Олай болса:

Газдың ішкі энергиясының өзгерісі:

Мұндағы:  – тұрақты көлемдегі газдың молярлық жылу сыйымдылығы. Екі атомды газдар үшін:
– тұрақты көлемдегі газдың молярлық жылу сыйымдылығы. Екі атомды газдар үшін:

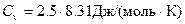
Енді газдың изобаралық ұлғаюы кезіндегі жұмысты келесі жолмен табамыз:

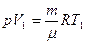 ;
; 
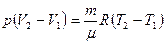

Шамалардың сан мәндерін орнына қойсақ:
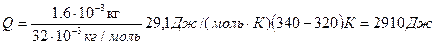


Дата публикования: 2015-11-01; Прочитано: 6216 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
