 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Стандартные теплоты образования и сгорания
|
|
Закон Гесса дает возможность рассчитать теплоты множества реакций по минимальному числу теплот некоторых реакций. Для этого используются стандартные теплоты.
Стандартная теплота образования (DНо f , 298) - это тепловой эффект реакции образования 1 моля вещества из простых веществ, взятых в их обычном соотношении и при стандартных условиях: Р = 1 атм, Т = 298 К.
Считают, что простые вещества реагируют в виде той модификации и в том агрегатном состоянии, которые отвечают наиболее устойчивому состоянию элементов при данных Р и Т. При этих условиях теплота образования принимается равной нулю (например, для О2, N2, S, C...). Соединения, для которых теплота образования DНо f , 298 положительна - эндотермические, для которых DНо f , 298 < 0 - экзотермические.
Зная стандартные теплоты образования всех участников реакции, можно рассчитать тепловой эффект самой реакции. Следствие из закона Гесса: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ.
а A + b B = c C + d D
(DНо298)x = c (DНо f , 298)C + d (DНо f , 298)D - a (DНо f , 298)A - b (DНо f , 298)B
(DНо298)x = å n (DНо f , 298)конеч.в-в - å n (DНо f , 298)нач.в-в
Стандартные теплоты образования табулированы.
Стандартная теплота сгорания (DHoc, 298) - тепловой эффект реакции взаимодействия 1 моля вещества с кислородом с образованием при этом продуктов полного окисления при стандартных условиях (Р = const, Т = 298 К). Тепловой эффект реакции можно рассчитать по теплотам сгорания исходных и конечных веществ:
(DНо298)x = å n (DНoc, 298)нач.в-в - å n (DНoc, 298)конеч.в-в
Теплоты сгорания часто используются для нахождения теплот реакций органических соединений, которые почти никогда не протекают однозначно и до конца. Это объясняется двумя причинами: 1) горение в кислороде является реакцией, общей для всех органических веществ и идущей при соблюдении некоторых условий до конца, т.е. полностью и однозначно; 2) техника сожжения органических веществ при V = const достигла высокого совершенства и позволяет определить теплоту сгорания с точностью до ± 0,02%. Комбинируя теплоты сгорания, можно вычислить теплоту любой химической реакции между органическими веществами. Примеры:
1. Найдем теплоту реакции
С6Н6 (ж) = 3С2Н2 DНоI =? (I)
Теплоты сгорания известны:
С6Н6 + 7 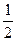 О2 = 6СО2 + 3Н2О (ж); DНоII = - 780980 кал (II)
О2 = 6СО2 + 3Н2О (ж); DНоII = - 780980 кал (II)
C2H2 + 2 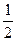 O2 = 2CO2 + H2O (ж); DHoIII = - 310620 кал (III)
O2 = 2CO2 + H2O (ж); DHoIII = - 310620 кал (III)
(I) = (II) - 3 (III); DHoI = DHoII - 3DHoIII = 150880 кал
2. Найдем с помощью теплот сгорания теплоту образования органического вещества: (теплота образования кислорода равна нулю)
С2Н2 + 2 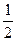 О2 = 2СО2 + Н2О; DНoc, 298 известна
О2 = 2СО2 + Н2О; DНoc, 298 известна
DНoc, 298 = 2  +
+ 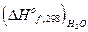 -
- 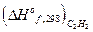
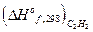 = 2
= 2 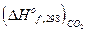 +
+ 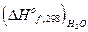 - DНoc, 298
- DНoc, 298
Недостаток расчета теплот реакций по теплотам сгорания (большой, но неизбежный) - уменьшение относительной точности получаемых результатов по сравнению с точностью исходных данных: во-первых, идет сложение ошибок, допущенных при измерении теплот сгорания органических реагентов; во-вторых, теплота реакции между реагентами почти всегда много меньше теплот сгорания реагентов. Во многих случаях относительная ошибка получаемой величины равна нескольким процентам (до нескольких десятков процентов).
ЗАВИСИМОСТЬ ТЕПЛОТЫ ПРОЦЕССА ОТ ТЕМПЕРАТУРЫ.
(Уравнения Кирхгоффа)
Рассмотренные выше теплоты химических реакций являются теплотами изотермических процессов и зависят от Т.
QV = DU = U2 - U1; QP = DH = H2 - H1
Продифференцируем эти равенства по Т при V (P) = const:
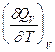 =
=  -
- 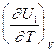 = CV,2 - CV,1 = DCV
= CV,2 - CV,1 = DCV
CV,2 - мольная теплоемкость при V = const всей массы продуктов реакции
CV,1 - всей массы исходных веществ
 =
= 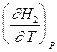 -
- 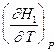 = CP,2 - CP,1 = DCР
= CP,2 - CP,1 = DCР
CV,2 - CV,1 = 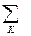 nкCV,к -
nкCV,к - 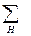 nнСV,н =
nнСV,н = 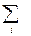 n i CV, i
n i CV, i
CP,2 - CP,1 = 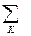 nкCP,к -
nкCP,к - 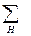 nнСP,н =
nнСP,н = 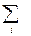 n i CP, i
n i CP, i
Уравнения Кирхгоффа дают зависимость теплоты химической реакции от Т. Дифференциальная форма записи уравнений:
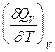 =
=  =
= 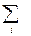 n i CV, i;
n i CV, i;  =
= 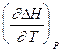 =
= 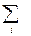 n i CP, i
n i CP, i
Для расчетов теплот реакций уравнения должны быть проинтегрированы:  =
= 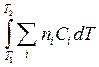
 ,
, 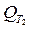 =
=  +
+ 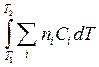 =
=  +
+  (Т2 - Т1)
(Т2 - Т1)
(Если интервал температур небольшой - десятки градусов - то С от Т практически не зависит и  можно считать постоянной величиной).
можно считать постоянной величиной).
Если Т изменяется в широком интервале, то С i ¹ const и для интегрирования надо знать зависимость С от Т. В широком интервале Т (не слишком низких - выше 200 К) зависимости С чистых веществ от Т могут быть выражены эмпирическими степенными рядами:
СР = a + b T + c T2 +... (для оргaнических веществ)
СР = a ¢ + b ¢T + c ¢T-2 (для неорганических веществ)
СР = a ¢¢ + b ¢¢T + c ¢¢T-1/2
Интегральная форма записи уравнений Кирхгоффа:
DНТ = DНо +  , DНТ = DН298 +
, DНТ = DН298 + 
Лекция 4
Дата публикования: 2015-11-01; Прочитано: 4348 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
